Efalizumab (Raptiva™) is niet langer verkrijgbaar. Het werd in 2009 van de markt gehaald. Deze informatiepagina is alleen van historisch belang.
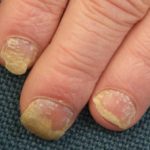
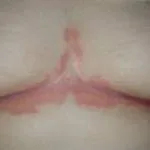
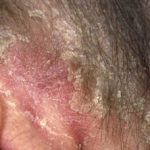
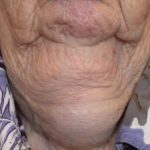
Efalizumab behoort tot de klasse van zogenaamde biologische responsmodificatoren T-cel blokkers. Het is een effectieve behandeling bij patiënten met matige tot ernstige klachten nummerplaat psoriasis.
Hoe werkt het?
Efalizumab is een genetisch gemodificeerde muisvorm eiwit die gericht is op blokkeren T-cel activatie en proliferatie binding aan CD11a-receptoren T-cellen. Dit voorkomt dat T-cellen vrijkomen cytokinen, welke zijn de primair oorzaak van de ontsteking, roodheid, jeuk en schilferende plekken op de huid die kenmerkend zijn voor psoriasis.
Hoe wordt het toegediend?
De eerste onderzoeken met efalizumab omvatten intraveneuze (IV) toediening van het geneesmiddel. Echter, een onderhuids (SOUTH CAROLINA) formulering is ontwikkeld en wordt momenteel gebruikt. Dosering eenmaal per week gedurende een periode van 12 weken verbetert de psoriasis tot op zekere hoogte bij ongeveer 50% van de patiënten.
Verbeteringen in psoriasis na twaalf weken behandeling kunnen worden gehandhaafd met aanvullende wekelijkse doses of met doses om de week.
Bijwerkingen
Efalizumab lijkt goed te worden verdragen. De meest gemelde bijwerkingen waren hoofdpijn, misselijkheid, koude rillingen, pijn, koorts en niet specifiek infectie zoals een gewone verkoudheid. Deze kwamen het vaakst voor na de eerste injectie en namen af bij volgende doses.
Behandelingsrisico's
Efalizumab is een immunosuppressivum en verhoogt daarom gevoeligheid a infecties.
WAARSCHUWING: 9 april 2009. Genetech heeft besloten om vrijwillig efalizumab (Raptiva) van de Amerikaanse markt te halen vanwege een potentieel verhoogd risico op progressief multifocale leuko-encefalopathie (PML).
19 februari 2009. Het Center for Drug Evaluation and Research van de Amerikaanse Food and Drug Administration (FDA) heeft een Public Health Notice uitgegeven met bijgewerkte veiligheidsinformatie over Raptiva (efalizumamb) naar aanleiding van vier meldingen van patiënten die dit medicijn gebruikten en die de zeldzame, levensbedreigende herseninfectie, progressieve multifocale leuko-encefalopathie (PML) en andere infecties.