Invoering
In augustus 2018 keurde de Amerikaanse Food and Drug Administration (FDA) lanadelumab (merknaam Takhzyro™) goed voor de preventie van erfgenaam angio-oedeem aanvallen bij patiënten ≥ 12 jaar. Dit medicijn werd door de FDA geëvalueerd in het kader van haar prioriteitsbeoordeling, die gereserveerd is voor medicijnen die aanzienlijke verbeteringen in de veiligheid vertegenwoordigen effectiviteit bij de behandeling van ernstige ziekten.
Het HELP-onderzoek
De HELP-studie was multicenter, gerandomiseerd, dubbelblind, placebo-Gecontroleerde parallelle groepsstudie bij 125 personen (115 volwassenen en 10 adolescenten), 12 jaar of ouder, met symptomatisch erfelijk angio-oedeem type I of II.
Studie ontwerp
Patiënten werden gerandomiseerd om lanadelumab te krijgen in de volgende doses:
- Lanadelumab 150 mg elke 4 weken (q4w) (n = 28)
- Lanadelumab 300 mg elke 4 weken (q4w) (n = 29)
- Lanadelumab 300 mg elke 2 weken (q2w) (n = 27)
- Placebo gedurende 26 weken (n = 41).
voor randomisatiemoesten patiënten van 18 jaar of ouder een langetermijnonderzoek van twee weken voltooien. profylaxe rustperiode (stoppen met medicijnen die worden gebruikt om angio-oedeem te voorkomen). Alle patiënten gingen vervolgens een inloopperiode van 4 weken in voordat ze zich inschreven voor de studie om de uitkomst te bepalen baseren angio-oedeem aanvalspercentage. Patiënten met één of meer door de onderzoeker bevestigde aanvallen van angio-oedeem tijdens de inloopperiode van vier weken kwamen in aanmerking voor opname in het onderzoek en randomisatie. de primair Het werkzaamheidseindpunt was het aantal door de onderzoeker bevestigde aanvallen tijdens de behandelingsperiode (van dag 0 tot dag 182).
de voor de helft De maandelijkse aanvalspercentages voor de verschillende behandelingsgroepen bij baseline tijdens de inloopperiode waren:
- Lanadelumab 150 mg elke 4 weken: 3.2
- Lanadelumab 300 mg elke 4 weken: 3.7
- Lanadelumab 300 mg elke 2 weken: 3.5
- Placebo4.
De resultaten lieten dat zien onderhuids Injecties elke 2 of 4 weken verminderden het maandelijkse aantal aanvallen in alle drie de behandelingsarmen met lanadelumab aanzienlijk vergeleken met placebo (P <0,001). A 300 mg cada 2 semanas, lanadelumab redujo el número medio de ataques de angioedema por mes en un 87% en comparación con placebo (ajustado P <0,001).
Tijdens de behandelingsperiode was het gemiddelde aantal aanvallen per maand:
- Lanadelumab 150 mg elke 4 weken: 0,48
- Lanadelumab 300 mg elke 4 weken: 0,53
- Landelumab 300 mg elke 2 weken: 0,26
- Placebo: 1,97.
Vergeleken met placebo waren de gemiddelde verschillen in aanvalspercentage per maand:
- Lanadelumab 150 mg elke 4 weken: -1,49 (95%-betrouwbaarheidsinterval [CI]: -1,90, -1,08; P <0,001)
- Lanadelumab 300 mg elke 4 weken: -1,44 (95% BI: -1,84, -1,04; P <0,001)
- Lanadelumab 300 mg elke 2 weken: -1,71 (95% BI: -2,09, -1,33: P <0,001).
De gemiddelde afname van het aantal aanvallen van erfelijk angio-oedeem was consistent hoger in de behandelingsgroepen met lanadelumab vergeleken met placebo, ongeacht de voorgeschiedenis van eerdere langetermijnprofylaxe. strottenhoofd aanvallen of aanvalspercentage tijdens de inbraakperiode.
Andere vooraf gedefinieerde verkennende eindpunten in het HELP-onderzoek omvatten het percentage patiënten dat aanvalsvrij was gedurende de gehele behandelingsperiode van 26 weken en het percentage patiënten dat drempelverlagingen bereikte in het aantal angio-oedeemaanvallen (≥50%, ≥ 70%, ≥ 90%) vergeleken met met basislijn.
Een afname van 50% of meer in het aantal angio-oedeemaanvallen werd waargenomen bij 100% van de patiënten die lanadelumab 300 mg elke 2 weken of elke 4 weken gebruikten en bij 89% van de patiënten die lanadelumab 150 mg elke 4 weken gebruikten, vergeleken met 32% van de placebopatiënten.
Een afname van 70% of meer in het aantal aanvallen van angio-oedeem werd waargenomen bij 89%, 76% en 79% van de patiënten die respectievelijk 300 mg lanadelumab elke 2 weken, 300 mg elke 4 weken en 150 mg elke 4 weken kregen, vergeleken met de 10% van placebo-patiënten.
Een afname van 90% of meer in het aantal aanvallen van angio-oedeem werd waargenomen bij 67%, 55% en 64% van de patiënten die respectievelijk 300 mg lanadelumab elke 2 weken, 300 mg elke 4 weken en 150 mg elke 4 weken kregen, vergeleken met de 5% van placebo-patiënten.
Vergeleken met de 2% van patiënten in de placebogroep was het percentage patiënten dat gedurende de gehele behandelingsperiode van 26 weken aanvalsvrij was:
- 44% in de groep die lanadelumab 300 mg elke 2 weken kreeg
- 31% in de groep die lanadelumab 300 mg elke 4 weken kreeg
- 39% in de groep die lanadelumab 150 mg elke 4 weken kreeg.
Limitaties van de studie
Er waren relatief weinig patiënten in elke behandelingsgroep. Het HELP-onderzoek was beperkt tot 26 weken en er kunnen geen conclusies worden getrokken over de veiligheid en werkzaamheid op de lange termijn.
Kwaliteit van leven gerelateerd aan gezondheid
De Angio-oedeem Kwaliteit van Leven Vragenlijst (AE-QoL) meet de impact van door de patiënt gerapporteerd angio-oedeem over een periode van vier weken. onthouden periode in vier domeinen: angst/schaamte, functioneren, vermoeidheid/stemming en voeding.
Alle behandelingsgroepen in het HELP-onderzoek vertoonden een verbetering in de totale AE-QoL-score vergeleken met placebo.
Het percentage patiënten dat een klinisch significante verbetering in de AE-QoL-totaalscore bereikte vergeleken met 37% van de patiënten in de placebogroep was:
- 65% in de groep die lanadelumab 150 mg iedere 4 weken kreeg (odds ratio vs. placebo = 3,2 [95% BI: 1,1–9,2])
- 63% in de groep die lanadelumab 300 mg elke 4 weken kreeg (2,9 [95% BI: 1,1–8,1])
- 81% in de groep met lanadelumab 300 mg elke 2 weken (7,2 [95% BI: 2,2–23,4]).
In week 26 rapporteerden patiënten een klinisch significante verbetering (een reductie van 6 punten) in alle domeinen van de AE-QoL-totaalscore. In alle behandelarmen met lanadelumab versus placebo rapporteerden patiënten na 26 weken:
- Minder angst en schaamte door onvoorspelbare aanvallen (kleinste kwadraten betekenen verandering ten opzichte van baseline -18,8 [standaarddeviatie (SD), 23,7] met lanadelumab versus -9 [SD, 24,0] met placebo)
- Minder verslechtering van het vermogen om te werken, te socialiseren en andere fysieke activiteiten uit te voeren (-29,3 [22,9] versus -5,4 [22,7])
- Minder vermoeidheid overdag en beter slapen ‘s nachts (-13 [23,1] vs. -1,8 [23,3])
- Minder beperkingen op eten en drinken (-17 [22,3] vs. -0,5 [22,5]).
Bijwerkingen
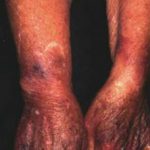
Het meest waargenomen tegengestelde reactie In verband met lanadelumab in het HELP-onderzoek waren reacties op de injectieplaats, waaronder pijn op de injectieplaats, erytheemen blauwe plekken op de injectieplaats. Deze reacties op de injectieplaats kwamen voor bij meer dan één op de tien patiënten.
Ander Bijwerkingen waargenomen bij een lagere frequentie (≥ 1/100 tot <1>
- overgevoeligheid
- Duizeligheid
- maculopapulair (morbilliforme) uitslag
- Spierpijn
- Is gestegen alaninetransaminase Y aspartaattransaminase.
Kinderen
De veiligheid van lanadelumab werd geëvalueerd bij een subgroep van 23 patiënten in de leeftijd van 12 tot 17 jaar. De resultaten van deze subgroepanalyse kwamen overeen met de algemene onderzoeksresultaten voor alle patiënten.
immunogeniciteit
Behandeling met lanadelumab ging gepaard met ontwikkelen van de opkomende anti-medicamenteuze behandeling antistoffen bij 10 van de 84 patiënten (11.9%). Alle antilichaam Titels Ze waren laag en veranderden niets farmacokinetiek Y farmacodynamisch lanadelumab-kenmerken of klinische respons.
Uitbreiding van de HELP-studie
De veiligheid en werkzaamheid van lanadelumab op de lange termijn als profylaxe ter voorkoming van erfelijke angio-oedeemaanvallen werd geëvalueerd in een open Uitbreiding van de HELP-studie.
Bij dit onderzoek waren zowel patiënten betrokken die het dubbelblinde HELP-onderzoek voltooiden (‘hernieuwde patiënten’; n=109) als patiënten die niet deelnamen aan het dubbelblinde onderzoek, waaronder patiënten die al dan niet een ander geneesmiddel gebruikten. profylactisch behandeling en die in het verleden een aanvankelijk aanvalspercentage hadden van meer dan één aanval per 12 weken (“non-rollover patiënten”; n = 103).
Rollover-patiënten ontvingen een enkele dosis van 300 mg lanadelumab op dag 0 en de tweede dosis na de eerste bevestigde angio-oedeemaanval van de patiënt. Daarna werd lanadelumab elke 2 weken toegediend.
Patiënten zonder rollover kregen elke 2 weken lanadelumab 300 mg, ongeacht de eerste aanval. Alle patiënten kregen hun laatste dosis op dag 350 (maximaal 26 doses), gevolgd door een follow-up van 4 weken.
Uit tussentijdse resultaten van de open-label uitbreiding van het HELP-onderzoek bleek dat behandeling met lanadelumab over het algemeen goed werd verdragen en consistent was met het eerder waargenomen veiligheidsprofiel. Op het moment van de tussentijdse analyse waren patiënten gemiddeld 8,21 (SD, 2,17) maanden blootgesteld aan lanadelumab en ervoeren nog steeds een vermindering van erfelijke angio-oedeemaanvallen.
Wat is het toekomstige potentieel van lanadelumab?
Erfelijk angio-oedeem is een potentieel levensbedreigende ziekte die resulteert in een aanzienlijke vermindering van de kwaliteit van leven.
- Lanadelumab heeft een nieuw werkingsmechanisme en kan gunstig zijn voor patiënten bij wie het angio-oedeem niet optimaal onder controle kan worden gebracht met andere medicijnen.
- De afname van het aanvalspercentage en, in sommige gevallen, de virtuele eliminatie van scherp aanvallen: Het zal waarschijnlijk de angst en stress als gevolg van toekomstige aanvallen verminderen, waardoor meer vrijheid ontstaat voor degenen die deelnemen aan sport of sociale activiteiten, en een grotere productiviteit op het werk.
- Subcutane behandeling voor profylaxe kan de last en de complexiteit van de toediening verminderen in vergelijking met intraveneuze toediening.
- Patiënten melden dat het vermogen om hun therapie zelf toe te dienen, kan leiden tot een groter gevoel van eigenwaarde controleren op de ziekte, een groter vermogen om een normaal leven te leiden en minder last voor zorgverleners.
- In gebieden waar de toegang tot medische zorg of on-demand therapie beperkt is, kan langdurige profylactische therapie levens redden.
- Houd er rekening mee dat nieuwe biologische therapieën vaak lang nadat ze op de markt zijn geïntroduceerd veiligheidsproblemen hebben die niet zijn ontdekt in onderzoeken voorafgaand aan de goedkeuring.
- Er zijn meer onderzoeken nodig om de werkzaamheid en veiligheid van lanadelumab op de lange termijn te bevestigen.