Cos'è il guselkumab?
Guselkumab è un trattamento biologico indicato per la psoriasi da moderata a grave.
La Food and Drug Administration (FDA) statunitense ha approvato guselkumab (Tremfya™, Janssen Biotech, PA, USA) per il trattamento di adulti affetti da malattie da moderate a gravi. targa psoriasi che sono candidati per sistemico terapia o fototerapia. Guselkumab è la prima e unica terapia biologica approvata che blocca solo selettivamente interleuchina 23 (IL-23), at citochina che svolge un ruolo chiave nella psoriasi a placche.
Le domande che richiedono l'approvazione di guselkumab nell'Unione Europea, in Giappone e in altri paesi sono attualmente in fase di revisione.
Nel luglio 2020, la FDA ha approvato guselkumab per il trattamento della psoriasi. artrite.
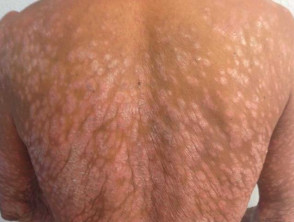
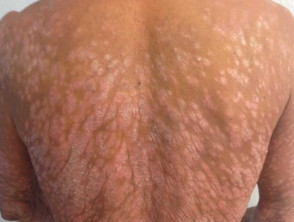
Psoriasi a placche grave
Psoriasi grave che colpisce la schiena
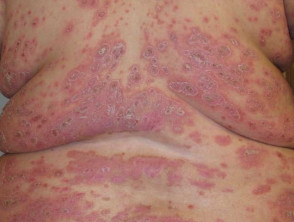
Grave psoriasi
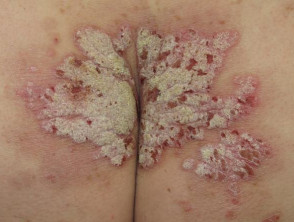
Glutei con psoriasi grave
A cosa serve il guselkumab?
- Guselkumab è usato per il trattamento di pazienti adulti con psoriasi a placche da moderata a grave candidati alla terapia sistemica o alla fototerapia (Radiazioni ultraviolette trattamento).
- Non è noto se guselkumab sia sicuro ed efficace nei bambini di età inferiore ai 18 anni.
Come funziona Guselkumab?
- Guselkumab è un essere umano monoclonale immunoglobuline G1 lambda (IgG1λ) anticorpo si lega selettivamente alla subunità p19 di IL-23 (a proteina coinvolto nel infiammatorio risposta) e inibisce la sua interazione con IL-23 ricevitore.
- Mentre IL-23 promuove le normali risposte infiammatorie e immunitarie, si scopre che le subunità p19 e p40 di IL-23 sono sovraespresse nella psoriasi e in altre condizioni. autoimmune malattie infiammatorie della pelle.
- Guselkumab si lega selettivamente alla subunità p19 di IL-23 in cellule dendritiche e cheratinociti e blocca la sua interazione con il recettore IL-23, che impedisce anche il rilascio di altri farmaci proinfiammatori citochine e chemochine attraverso la stimolazione di cellule immunitarie, come le cellule T helper 17 (Th17).
- Guselkumab blocca così la segnalazione anormalmente alta delle cascate infiammatorie (il processo di reazione a catena che attiva la risposta immunitaria) che epidermico anomalieCompreso cheratinociti iperproliferazione (guarigione non soppressa della ferita) e formazione di placche psoriasiche.
Come viene somministrato il guselkumab?
- Guselkumab è somministrato da sottocutaneo iniezione.
- La dose raccomandata è di 100 mg alla settimana 0, alla settimana 4 e successivamente ogni 8 settimane.
- Guselkumab non deve essere iniettato in aree in cui la pelle è tenera, livida, arrossata, dura, spessa, squamosoo affetti da psoriasi.
- È destinato all'uso sotto la guida e la supervisione di un medico.
- Guselkumab può essere somministrato da un operatore sanitario o un paziente può auto-iniettarsi dopo un'adeguata formazione nella tecnica di iniezione sottocutanea.
- Guselkumab può aumentare il rischio di infezione.
- La dose dimenticata deve essere iniettata non appena se ne ricorda e la dose successiva deve essere somministrata all'orario programmato appropriato.
Valutazione pretrattamento per tubercolosi e immunizzazione
- Il trattamento con Guselkumab non deve essere iniziato in pazienti con infezioni attive clinicamente importanti fino a quando l'infezione non si risolve o non viene adeguatamente trattata.
- Pazienti con una storia di latente la tubercolosi deve essere trattata in modo appropriato prima della somministrazione di guselkumab poiché può riattivare l'infezione tubercolare latente.
- I pazienti non devono essere immunizzati con vaccini vivi durante il trattamento con guselkumab.
Utilizzare in popolazioni specifiche
Donne incinte
- Non sono disponibili dati sull'uso di guselkumab nelle donne in gravidanza, indicando un rischio associato al farmaco di gravi difetti alla nascita e aborto spontaneo.
- Non negativo evolutivo Gli effetti sono stati osservati nella prole di età compresa tra 0 e 6 mesi scimmie cynomolgus trattati con guselkumab fino a 30 volte la dose umana massima raccomandata.
- Vedere la pagina DermNet NZ sulla sicurezza dei farmaci assunti durante la gravidanza.
Mamme e bambini che allattano
- Non ci sono informazioni sulla presenza di guselkumab nel latte materno o sui suoi effetti sul lattante.
- Il potenziale rischio-beneficio deve essere considerato quando si prescrive guselkumab alla madre.
- Vedi la pagina DermNet NZ su allattamento al seno e pelle.
Bambini
La sicurezza e l'efficacia di guselkumab in pediatrico i pazienti non sono stati valutati <18 años.
Anziani
Gli studi clinici con guselkumab non hanno incluso un numero sufficiente di pazienti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso dai soggetti più giovani.
Pazienti con epatica o renale disabilità
Non sono stati effettuati studi per valutare l'effetto della compromissione epatica o renale su farmacocinetica di Guselkumab.
Effetti avversi di guselkumab
Il più comune Reazioni avverse (≥ 1% di pazienti) riportati includono:
- Vie respiratorie superiori infezioni
- Mal di testa
- Reazioni al sito di iniezione
- Artralgia
- Diarrea
- Influenza intestinale
- infezione da tigna
- Herpes simplex infezione.
Interazioni farmacologiche con guselkumab
- Non sono disponibili dati sulla capacità dei vaccini vivi o inattivati di suscitare una risposta immunitaria nei pazienti che ricevono il trattamento con guselkumab.
- I vaccini vivi non dovrebbero essere usati. contemporaneamente durante il trattamento con guselkumab.
- Popolazione farmacocinetica Le analisi hanno indicato che il concomitante l'uso di ibuprofene, aspirina o paracetamolo non influisce sulla clearance di guselkumab.
- L'effetto dei farmaci metabolizzati attraverso il citocromo epatico P450 enzimi (p. es., warfarin e ciclosporina) possono essere alterati durante la co-somministrazione con guselkumab. Deve essere presa in considerazione la modifica della dose di questi farmaci.
- I risultati di uno studio esplorativo di interazione farmacologica in pazienti con psoriasi da moderata a grave hanno suggerito un basso potenziale di interazioni farmacologiche clinicamente rilevanti per i farmaci metabolizzati da CYP3A4 (midazolam), CYP2C9 (warfarin), CYP2C19 (omeprazolo) e CYP1A2 (caffeina). , ma non può essere esclusa la potenziale interazione per i farmaci metabolizzati dal CYP2D6 (metoprololo).
Controindicazioni guselkumab
Guselkumab non deve essere utilizzato in pazienti che:
- Hai un'infezione che non va via o ritorna.
- Sono stati o sono stati in stretto contatto con qualcuno affetto da tubercolosi
- Ricevuto di recente o in programma per ricevere una vaccinazione
- Stai pianificando una gravidanza
- Allattamento al seno o pianificazione di allattare.
Guselkumab mostra risultati promettenti per la psoriasi a placche negli studi di fase III.
- Guselkumab ha mostrato un profilo di sicurezza accettabile e buono efficacia nel trattamento della psoriasi a placche da moderata a grave.
- È una terapia biologica di prim'ordine che blocca selettivamente solo IL-23, una citochina che svolge un ruolo chiave nella psoriasi a placche.
- Guselkumab ha dimostrato più alto risulta in un alleggerimento della pelle rispetto ad adalimumab nelle analisi testa a testa.
- I risultati degli studi clinici hanno anche dimostrato l'efficacia di guselkumab nei pazienti che hanno avuto una risposta inadeguata al trattamento con ustekinumab.
- È in corso uno studio di fase III per valutare guselkumab nel trattamento dell'artrite psoriasica attiva ed è in corso un programma di fase III per valutare l'efficacia di guselkumab rispetto a secukinumab nel trattamento della psoriasi a placche da moderata a grave.
- Sebbene siano necessari ulteriori studi per valutare la sicurezza e l'efficacia a lungo termine, sulla base dei risultati fino ad oggi, il guselkumab sembra essere un farmaco promettente. terapeutico opzione per la psoriasi a placche da moderata a grave.