¿Qué es guselkumab?
Guselkumab es un tratamiento biológico indicado para la psoriasis de moderada a grave.
La Administración de Drogas y Alimentos de los EE. UU. (FDA) ha aprobado guselkumab (Tremfya ™, Janssen Biotech, PA, EE. UU.) Para el tratamiento de adultos que viven con enfermedades moderadas a graves. placa psoriasis que son candidatos a sistémico terapia o fototerapia. Guselkumab es la primera y única terapia biológica aprobada que bloquea selectivamente solo interleucina 23 (IL-23), a citocina que juega un papel clave en la psoriasis en placas.
Las solicitudes que buscan la aprobación de guselkumab en la Unión Europea, Japón y otros países se encuentran actualmente en revisión.
En julio de 2020, la FDA aprobó guselkumab para el tratamiento de la psoriasis. artritis.
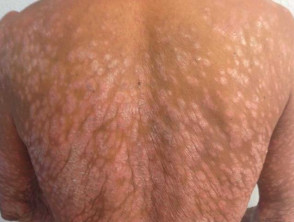
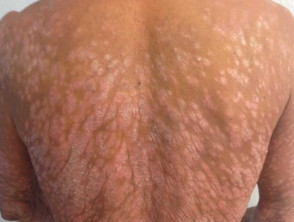
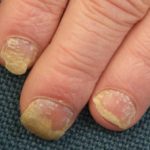
Psoriasis en placas severa
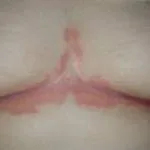
Psoriasis severa que afecta la espalda
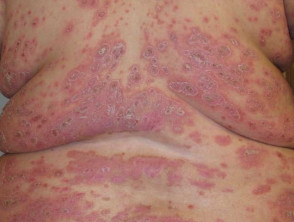
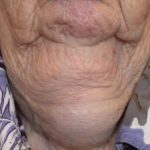
Psoriasis severa
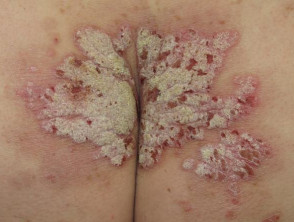
Nalgas de psoriasis severa
¿Para qué se utiliza guselkumab?
- Guselkumab se utiliza para el tratamiento de pacientes adultos con psoriasis en placas de moderada a grave que son candidatos a terapia sistémica o fototerapia (Radiación ultravioleta tratamiento).
- No se sabe si guselkumab es seguro y eficaz en niños menores de 18 años.
¿Cómo actúa guselkumab?
- Guselkumab es un ser humano monoclonal inmunoglobulina G1 lambda (IgG1λ) anticuerpo que se une selectivamente a la subunidad p19 de IL-23 (una proteína involucrado en el inflamatorio respuesta) e inhibe su interacción con la IL-23 receptor.
- Mientras que IL-23 promueve respuestas inflamatorias e inmunes normales, se encuentra que las subunidades p19 y p40 de IL-23 se sobreexpresan en la condición de psoriasis y otras autoinmune enfermedades inflamatorias de la piel.
- Guselkumab se une selectivamente a la subunidad p19 de IL-23 en células dendríticas y queratinocitos y bloquea su interacción con el receptor de IL-23, que además previene la liberación de otros proinflamatorios citocinas y quimiocinas a través de la estimulación de células inmunes, como las células T auxiliares 17 (Th17).
- Guselkumab bloquea así la señalización anormalmente elevada de las cascadas inflamatorias (el proceso de reacción en cadena que activa la respuesta inmune) que epidérmico anormalidades, incluyendo queratinocito hiperproliferación (cicatrización de heridas no suprimida) y formación de placa psoriásica.
¿Cómo se administra guselkumab?
- Guselkumab es administrado por subcutáneo inyección.
- La dosis recomendada es de 100 mg en la semana 0, semana 4 y cada 8 semanas a partir de entonces.
- Guselkumab no debe inyectarse en áreas donde la piel esté sensible, amoratada, enrojecida, dura, gruesa, escamoso, o afectados por psoriasis.
- Está diseñado para su uso bajo la guía y supervisión de un médico.
- Guselkumab puede ser administrado por un profesional de la salud o un paciente puede autoinyectarse después de haber recibido el entrenamiento adecuado en la técnica de inyección subcutánea.
- Guselkumab puede aumentar el riesgo de infección.
- La dosis omitida debe inyectarse tan pronto como se recuerde, y la siguiente dosis debe administrarse a la hora programada adecuada.
Evaluación previa al tratamiento de tuberculosis e inmunización
- El tratamiento con guselkumab no debe iniciarse en pacientes con alguna infección activa clínicamente importante hasta que la infección se resuelva o se trate adecuadamente.
- Pacientes con antecedentes de latente tuberculosis debe tratarse adecuadamente antes de la administración de guselkumab, ya que puede reactivar la infección tuberculosa latente.
- Los pacientes no deben ser inmunizados con vacunas vivas durante el tratamiento con guselkumab.
Uso en poblaciones específicas
Mujeres embarazadas
- No hay datos disponibles para el uso de guselkumab en mujeres embarazadas, lo que indica que existe un riesgo asociado al fármaco relacionado con defectos de nacimiento importantes y abortos espontáneos.
- No adverso de desarrollo Se observaron efectos en la descendencia de 0 a 6 meses de edad en monos cynomolgus tratados con guselkumab hasta 30 veces la dosis máxima recomendada para humanos.
- Consulte la página de DermNet NZ sobre la seguridad de los medicamentos que se toman durante el embarazo.
Madres y bebés que amamantan
- No hay información sobre la presencia de guselkumab en la leche materna o sus efectos en el lactante.
- Se debe considerar el potencial riesgo-beneficio al prescribir guselkumab a la madre.
- Consulte la página de DermNet NZ sobre la lactancia y la piel.
Niños
La seguridad y eficacia de guselkumab en pediátrico no se han evaluado pacientes <18 años.
Personas mayores
Los estudios clínicos con guselkumab no incluyeron un número suficiente de pacientes de 65 años para determinar si responden de manera diferente a los sujetos más jóvenes.
Pacientes con hepático o renal discapacidad
No se han realizado ensayos para evaluar el efecto de la insuficiencia hepática o renal en la farmacocinética de guselkumab.
Efectos adversos del guselkumab
Los más comunes Reacciones adversas (≥ 1% de los pacientes) notificados incluyen:
- Respiratorio superior infecciones
- Dolor de cabeza
- Reacciones en el lugar de la inyección
- Artralgia
- Diarrea
- Gastroenteritis
- Infección por tiña
- Herpes simplex infección.
Interacciones farmacológicas con guselkumab
- No hay datos disponibles sobre la capacidad de las vacunas vivas o inactivas para provocar una respuesta inmunitaria en pacientes que reciben tratamiento con guselkumab.
- No se deben utilizar vacunas vivas. concomitantemente durante el tratamiento con guselkumab.
- Población farmacocinético Los análisis han indicado que el concomitante el uso de ibuprofeno, aspirina o paracetamol no afecta el aclaramiento de guselkumab.
- El efecto de los fármacos metabolizados a través del citocromo P450 hepático enzimas (p. ej., warfarina y ciclosporina) pueden alterarse durante la administración concomitante con guselkumab. Se debe considerar la modificación de la dosis de estos medicamentos.
- Los resultados de un estudio exploratorio de interacciones medicamentosas en pacientes con psoriasis de moderada a grave han sugerido un bajo potencial de interacciones medicamentosas clínicamente relevantes para los medicamentos metabolizados por CYP3A4 (midazolam), CYP2C9 (warfarina), CYP2C19 (omeprazol) y CYP1A2 ( cafeína), pero no se puede descartar el potencial de interacción para fármacos metabolizados por CYP2D6 (metoprolol).
Contraindicaciones guselkumab
Guselkumab no debe usarse en pacientes que:
- Tiene una infección que no desaparece o que vuelve a aparecer.
- Tiene o ha estado en contacto cercano con alguien con TB
- Recibió recientemente o está programado para recibir una vacuna
- Planea quedar embarazada
- Amamantando o planea amamantar.
Guselkumab es prometedor para la psoriasis en placas en estudios de fase III.
- Guselkumab ha mostrado un perfil de seguridad aceptable y una buena eficacia en el tratamiento de la psoriasis en placas de moderada a grave.
- Es una terapia biológica de primera en su clase que bloquea selectivamente solo IL-23, una citocina que juega un papel clave en la psoriasis en placas.
- Guselkumab ha demostrado superior da como resultado el aclaramiento de la piel en comparación con el adalimumab en análisis comparativos.
- Los resultados de los ensayos clínicos también han demostrado la eficacia de guselkumab en pacientes que tuvieron una respuesta inadecuada al tratamiento con ustekinumab.
- Está en curso un estudio de fase III que evalúa guselkumab en el tratamiento de la artritis psoriásica activa, y está en curso un programa de fase III que evalúa la eficacia de guselkumab en comparación con secukinumab en el tratamiento de la psoriasis en placas de moderada a grave.
- Aunque se necesitan más estudios para evaluar la seguridad y la eficacia a largo plazo, según los resultados hasta la fecha, guselkumab parece ser un fármaco prometedor. terapéutico opción para la psoriasis en placas de moderada a grave.