Terminologia squamosa anogenitale inferiore
Introduzione In questa pagina viene descritta l'evoluzione della terminologia utilizzata per descrivere la condizione precedentemente nota come intraepiteliale vulvare. neoplasia (VIN). Nel 2015, la Società Internazionale per lo Studio della Malattia Vulvovaginale (ISSVD) ha adottato il termine lesione intraepiteliale squamosa (SIL) vulvare (vulva). Se non trovi quello che cerchi in questo elenco, prova il nostro glossario, Indice […]
Pembrolizumab

Applicazione pubblicitaria per il cancro della pelle per facilitare l'autoesame della pelle e la diagnosi precoce. Per saperne di più. Testo: Miiskin Cos'è pembrolizumab? Pembrolizumab (precedentemente noto come lambrolizumab; nome commerciale Keytruda®) è un farmaco commercializzato da Merck and Co (New Jersey, USA) che prende di mira il recettore della morte cellulare programmata 1 (PD-1). Lui […]
Evidenze chiave dagli studi clinici per vismodegib
Introduzione L'approvazione di vismodegib si è basata sui risultati dello studio cardine ERIVANCE sul carcinoma basocellulare (BCC). ERIVANCE BCC è stato uno studio internazionale di Fase II, a braccio singolo, multicentrico, a due coorti, in aperto, che ha arruolato 104 pazienti con BCC avanzato, inclusi BCC localmente avanzato (n=71) e BCC metastatico […]
Evidenze chiave dagli studi clinici per trametinib
Introduzione Il 29 maggio 2013, la Food and Drug Administration (FDA) statunitense ha approvato trametinib (compresse MEKINIST™, GlaxoSmithKline, USA), come trattamento orale monoagente per pazienti affetti da malattie non infiammatorie, melanoma operabile (melanoma che non può essere rimosso chirurgicamente) o melanoma metastatico (melanoma che ha […]
Evidenze chiave dagli studi clinici per sonidegib
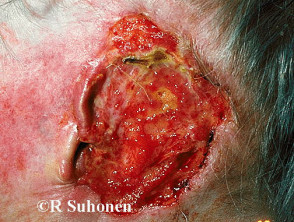
Introduzione A luglio 2015, la Food and Drug Administration (FDA) statunitense ha approvato sonidegib (Odomzo®; Novartis, New Jersey, USA) per il trattamento di pazienti adulti con carcinoma basocellulare (BCC). La Commissione europea ha approvato l'uso di sonidegib per il carcinoma basocellulare nell'agosto 2015. A giugno […]
Evidenze chiave dagli studi clinici per lanadelumab
Introduzione Nell'agosto 2018, la Food and Drug Administration (FDA) statunitense ha approvato lanadelumab (nome commerciale Takhzyro™) per la prevenzione degli attacchi di angioedema ereditario nei pazienti di età ≥ 12 anni. Questo farmaco è stato valutato dalla FDA nell'ambito della sua revisione prioritaria, riservata ai farmaci che rappresentano miglioramenti significativi […]
Evidenze chiave dagli studi clinici per ixekizumab
Introduzione Ixekizumab (Taltz®) è un anticorpo monoclonale umanizzato immunoglobulina G sviluppato da Eli Lilly and Company che è stato approvato negli Stati Uniti (marzo 2016) e in Europa (aprile 2016) come trattamento per la psoriasi a placche. Ixekizumab è un inibitore dell’interleuchina-17A (IL-17A), una citochina proinfiammatoria che ha un ruolo nello sviluppo di diverse condizioni […]
Evidenze chiave da studi clinici per ingenolo mebutato gel
30 gennaio 2020 – Il Regno Unito e l'Europa sospendono la commercializzazione di Picato® Gel. L'Agenzia di regolamentazione dei medicinali e dei prodotti sanitari del Regno Unito [1] e l'Agenzia europea per i medicinali (EMA) [2] hanno annunciato che la commercializzazione del gel Picato® contenente ingenolo mebutato è stata sospesa. Hanno raccomandato ai pazienti […]
Evidenze chiave dagli studi clinici per guselkumab
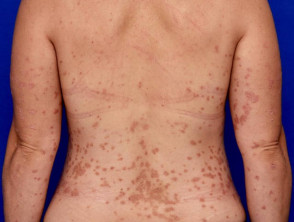
Introduzione Nel luglio 2017, la Food and Drug Administration (FDA) statunitense ha approvato guselkumab (Tremfya™; Janssen Biotech, PA, USA) per il trattamento degli adulti con sintomi di psoriasi a placche da moderata a grave, candidati alla terapia sistemica o alla fototerapia. Guselkumab è la prima e unica terapia biologica approvata […]
Evidenze chiave dagli studi clinici per dabrafenib
Cos'è dabrafenib? Dabrafenib è un farmaco biodisponibile per via orale. inibitore della proteina BRAF mutante in pazienti con melanoma. Il 29 maggio 2013, la Food and Drug Administration (FDA) statunitense ha approvato dabrafenib (capsula TAFINLAR™, GlaxoSmithKline, LLC), per il trattamento di pazienti con melanoma inoperabile o metastatico […]
