introduzione
Nel marzo 2016, la FDA statunitense ha approvato il trattamento biologico ixekizumab (TALTZ™ Eli Lilly, Indiana, USA) Per il trattamento della psoriasi. Nel novembre 2017 è stato approvato anche per la psoriasi attiva. artrite.
Nell'aprile 2016, l'Agenzia europea dei medicinali ha anche concesso l'autorizzazione all'immissione in commercio di ixekizumab per il trattamento di adulti con malattia da moderata a grave. targa psoriasi che sono candidati per sistemico terapia.
Ixekizumab è un umanizzato immunoglobuline G sottoclasse 4 (IgG4) monoclonale anticorpo (mAb) con attività neutralizzante contro IL-17A. Guadare Interleuchina-17 pollici infiammatorio disturbi della pelle.
È prodotto da ricombinante DNA tecnologia in una linea cellulare di mammifero ed è composto da due identici polipeptidi della catena leggera di 219 aminoacidi ciascuno e due identici polipeptidi a catena pesante di 445 amminoacidi ciascuno.
A cosa serve ixekizumab?
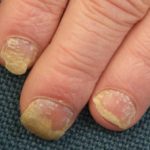
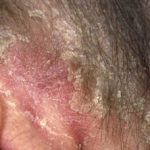
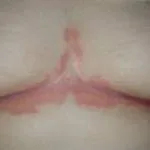
Ixekizumab è usato per il trattamento della psoriasi a placche da moderata a grave in pazienti adulti candidati alla terapia sistemica (farmaco che viene assorbito nel flusso sanguigno) o alla fototerapia (trattamento con luce ultravioletta). È stato anche dimostrato che migliora la psoriasi del cuoio capelluto e un psoriasi.
Come funziona ixekizumab?
- La psoriasi è caratterizzata da infiammazione e cheratinociti iperproliferazione pensava fosse lui patologico conseguenza di a Cellula T.–Risposta immuno-mediata a un organismo non ancora identificato autoantigen.
- Gli studi hanno dimostrato che un sottoinsieme di CD4+ Cellule T., le cellule T helper di tipo 17 (Th17), possono svolgere un ruolo patologico specifico nella psoriasi.
- Le cellule T helper di tipo 17 secernono una serie di pro-infiammatorio citochine, inclusa l'interleuchina-17A, un membro dell'interleuchina-17 proinfiammatoria citochina (Corriere di consegna proteina) famiglia.
- Specifica inibizione l'interleuchina-17A rappresenta un approccio nuovo e mirato al trattamento della psoriasi.
Dosaggio e somministrazione
- Ixekizumab è somministrato da sottocutaneo iniezione, utilizzando un autoiniettore.
- La dose raccomandata è 160 mg (due iniezioni da 80 mg) alla settimana 0, seguita da 80 mg alle settimane 2, 4, 6, 8, 10 e 12, quindi 80 mg ogni 4 settimane.
- Ixezinumab è disponibile come autoiniettore monodose e siringa preriempita.
- I pazienti possono auto-iniettarsi dopo l'allenamento nella tecnica di iniezione sottocutanea utilizzando l'autoiniettore o la siringa preriempita.
- Ogni iniezione viene somministrata in una posizione anatomica diversa (come la parte superiore delle braccia, le cosce o qualsiasi quadrante dell'addome) ma non in aree in cui la pelle è dolente, contusa, eritematoso, difficile o affetti da psoriasi.
- La dose dimenticata deve essere somministrata il prima possibile. Successivamente, il dosaggio riprende all'orario regolarmente programmato.
- Prima dell'iniezione, rimuovere l'autoiniettore di TALTZ o la siringa preriempita di TALTZ dal frigorifero e lasciare che TALTZ raggiunga la temperatura ambiente (30 minuti) senza rimuovere il coperchio dell'ago.
- TALTZ è trasparente e da incolore a leggermente giallo. soluzione e non deve essere utilizzato se il liquido contiene particelle visibili, è scolorito o torbido.
Collegamento a prove chiave da studi clinici su ixekizumab
Possibili interazioni farmacologiche con ixekizumab
- Non formale farmacocinetica Sono stati condotti studi di interazione farmacologica con ixekizumab.
- Modifica della dose di CYP450 substrati come warfarin e ciclosporina quando si inizia o si interrompe il trattamento con ixekizumab.
Quali sono gli effetti collaterali di ixekizumab?
Ixekizumab è molto ben tollerato. Più comune (≥ 1%) Reazioni avverse associati al trattamento con ixekizumab sono:
- Reazioni al sito di iniezione
- Tratto respiratorio superiore infezioni
- Nausea
- infezioni da lieviti
- Infezioni da tigna.
Reazioni avverse meno comuni (<1%) incluyen:
- Rinite
- Candidosi orale
- Orticaria
- Influenza
- Congiuntivite
- Malattia infiammatoria intestinale
- Angioedema
Avvertenze e precauzioni
- I pazienti devono essere istruiti a consultare un medico se segni o sintomi di cronica o acuto infezione verificarsi.
- Ixekizumab aumenta il rischio di infezione e deve essere sospeso fino alla risoluzione dell'infezione.
- I pazienti che ricevono ixekizumab devono essere attentamente monitorati per segni e sintomi di tubercolosi attiva (TB) durante e dopo il trattamento.
- Ixekizumab non deve essere somministrato a pazienti con infezione da tubercolosi attiva.
- Trattamento di latente La tubercolosi deve essere iniziata prima del trattamento con ixekizumab.
- Ixekizumab deve essere interrotto immediatamente e deve essere iniziato un trattamento appropriato in caso di malattia grave ipersensibilità reazione come mancanza di respiro, senso di costrizione alla gola, angioedema o orticaria.
- Durante gli studi clinici, morbo di Crohn e ulcere coliteCompreso esacerbazioni, si è verificato più frequentemente nel gruppo ixekizumab (morbo di Crohn 0,1%, colite ulcerosa 0,2%) rispetto al gruppo placebo gruppo (0%).
- I pazienti devono essere monitorati per la comparsa o le esacerbazioni di malattie infiammatorie intestinali durante il trattamento con ixekizumab.
- Evitare l'uso di vaccini vivi nei pazienti trattati con ixekizumab.
Uso di ixekizumab durante la gravidanza
- Non sono disponibili dati sull'uso di ixekizumab nelle donne in gravidanza.
- È noto che le IgG umane attraversano la barriera placentare e ixekizumab, che è un IgG4, ha il potenziale per essere trasmesso da madre a figlio. sviluppando feto.
- Negli studi sulla riproduzione animale, la somministrazione di ixekizumab a scimmie cynomolgus dall'inizio di organogenesi fino a quando il parto non ha provocato la morte prematura del feto.
Uso di ixekizumab nelle madri che allattano
- Non è noto se ixekizumab o il suo metaboliti sono presenti nel latte materno.
- Si deve consigliare alle donne di interrompere l'allattamento al seno durante il trattamento.
Pediatrico uso di ixekizumab
La sicurezza e l'efficacia di ixekizumab nei pazienti pediatrici (<18 años).
Uso geriatrico di ixekizumab
Gli studi clinici su ixekizumab non hanno incluso un numero sufficiente di pazienti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso dai pazienti più giovani.
Renale o epatica deterioramento e ixekizumab
Non sono stati condotti studi formali sull'effetto dell'insufficienza epatica o renale sul farmacocinetica di ixekizumab.