Introducción
El 29 de mayo de 2013, la Administración de Drogas y Alimentos de los EE. UU. (FDA) aprobó trametinib (tabletas MEKINIST ™, GlaxoSmithKline, LLC), como un tratamiento de agente único para pacientes con enfermedades no operables o metastásico melanoma con BRAF V600E o V600K mutaciones según lo detectado por una prueba aprobada por la FDA, llamada THxID ™ – ensayo BRAF de bioMérieux SA En noviembre de 2015, la FDA aprobó la combinación de dabrafenib y trametinib para el tratamiento del melanoma metastásico. Trametinib está aprobado por MedSafe, solo y en combinación con dabrafenib, pero no está subvencionado por PHARMAC en Nueva Zelanda.
Las mutaciones BRAF ocurren en el 50% de melanomas. Objetivos de trametinib mutante BRAF proteína inhibiendo el MAPK vía de señalización, que media el crecimiento y la supervivencia celular.
¿Cómo actúa trametinib?
- Trametinib tiene un mecanismo de acción relacionado, pero ligeramente diferente, al dabrafenib.
- Actúa como una quinasa regulada por señales extracelulares activada por mitógenos (MEK) inhibidor en la vía de señalización de la proteína quinasa activada por mitógenos (MAPK), que media el crecimiento y la supervivencia celular.
- La RAS / RAF / MEK / ERK (vía MAPK) es una cascada de transducción de señales crítica implicada en el descontrolado proliferación de muchos cánceres humanos.
- En cáncer, RAF mutado (por ejemplo, B-RAF mutante) y RAS proteinas puede conducir a la hiperactivación de la vía MAPK, lo que resulta en un aumento de la proliferación, diseminación y supervivencia celular.
- Las mutaciones que bloquean la proteína B-RAF en un estado activo pueden causar una señalización excesiva en la vía MAPK, lo que lleva a un crecimiento descontrolado de melanocitos (pigmento células).
- Se cree que MEK es un importante objetivo farmacológico para el tratamiento del cáncer que puede implicar una señalización mejorada de RAS / RAF, debido a su papel central en esta vía.
- Cuando la actividad de B-RAF mutante se bloquea a través de MEK inhibidores, las células cancerosas dejan de crecer y mueren.
¿Qué pacientes se benefician más del trametinib?
- Trametinib está indicado específicamente para pacientes con melanoma cuyos tumores expresan gene mutaciones llamadas BRAF V600E y V600K, detectadas por una prueba aprobada por la FDA.
- La proteína BRAF producida como resultado de este gen. mutación tiene el aminoácidos (componente básico de la proteína) glutamato, en lugar del aminoácido valina, en la posición 600.
- Trametinib no está indicado para su uso en melanoma sin la mutación V600.
- Trametinib tampoco está indicado para el tratamiento de pacientes que hayan recibido previamente Inhibidor de BRAF terapia para el melanoma.
Enlace a evidencia clave de ensayos clínicos sobre trametinib.
Dosificación y administración
La dosis recomendada de trametinib es de 2 mg por vía oral una vez al día, tomados al menos 1 hora antes o al menos 2 horas después de una comida. La dosis olvidada no debe tomarse dentro de las 12 horas posteriores a la siguiente dosis.
Se recomienda la modificación de la dosis o la retirada parcial / completa del fármaco en el caso de piel grave. toxicidad, cardiomiopatía, ocular y pulmonar anormalidades.
¿Cuáles son los efectos secundarios del trametinib?
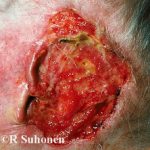
En los ensayos clínicos con trametinib, los efectos secundarios más frecuentes que afectaron a ≥10% de los pacientes y de cualquier grado fueron:
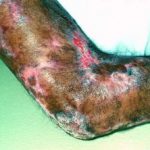
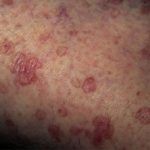
- erupción (57%),
- diarrea (43%),
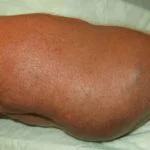
- linfedema (32%)
- acneiforme dermatitis (19%)
- estomatitis (15%)
- hipertensión (15%)
- dolor abdominal (13%)
- hemorragia (13%)
- piel seca (11%)
- prurito/ picazón (10%)
- paroniquia (10%).
Grave Reacciones adversas (afectando ≥2%), es decir, los grados 3 y 4 fueron:
- hipertensión (12%)
- erupción (8%)
- prurito (2%)
- estomatitis (2%).
Advertencias y precauciones
En los ensayos clínicos, también se han observado las siguientes reacciones adversas con trametinib.
- Cardiomiopatía
El 11% de los pacientes desarrollaron evidencia de miocardiopatía (disminución de la eyección del ventrículo izquierdo fracción por debajo de los límites inferiores de lo normal). - Pigmento de retina epitelial destacamentos
los incidencia de desprendimiento rápido del epitelio pigmentario fue del 0,8%. Los desprendimientos de retina eran a menudo bilateral y multifocal, que ocurre en el macular región de la retina. - Vena retiniana oclusión
La incidencia de oclusión de la vena retiniana (OVR) fue del 0,2%. RVO puede conducir a macular edema, disminución de la función visual, neovascularización (nueva vaso sanguíneo formación), y glaucoma. - Intersticial enfermedad pulmonar
A la dosis recomendada, enfermedad pulmonar intersticial o neumonitis Ocurrió en el 1.8% de los pacientes que requirieron hospitalización.
El embarazo
Trametinib puede causar daño fetal cuando se administra a una mujer embarazada (categoría D de embarazo). Se debe advertir a la paciente del peligro potencial para el feto si este medicamento se usa durante el embarazo o si la paciente queda embarazada mientras toma este medicamento. Se debe aconsejar a las pacientes que utilicen anticonceptivos de gran eficacia durante el tratamiento con trametinib y durante 4 meses después de la interrupción del tratamiento.
Pediátrico utilizar
Hasta la fecha, no se han realizado estudios que evalúen trametinib en niños.
Uso geriátrico
Los estudios clínicos de trametinib no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de manera diferente a los sujetos más jóvenes.
Hepático y renal discapacidad
No se ha realizado ningún estudio clínico formal para evaluar el efecto de la insuficiencia renal y hepática en el farmacocinética de trametinib. No se recomiendan ajustes de dosis en pacientes con insuficiencia renal o hepática leve según la población. farmacocinético estudios.
Interacciones con la drogas
No se han realizado estudios formales de interacciones medicamentosas para evaluar el citocromo P450 humano (CYP). enzimaInteracciones medicamentosas mediadas por trametinib.
Direcciones futuras para trametinib
- En comparación con la mayoría de los otros inhibidores de MEK en desarrollo, trametinib tiene un perfil farmacocinético (PK) único que proporciona una exposición prolongada después de la administración una vez al día, con una relación de concentración pico a mínima baja y niveles sostenidos de molecular objetivo inhibición.
- Dabrafenib y trametinib fueron aprobados para su uso como monoterapia en 2013. La combinación de dabrafenib y trametinib, Mekinist ™, fue aprobada provisionalmente por la FDA para irresecable y melanoma metastásico con mutaciones BRAF V600E o V600K, en 2014, y se obtuvo la aprobación regular en noviembre de 2015. La terapia de combinación se dirige a múltiples componentes de la señalización celular y proporciona tasas de respuesta más altas y un beneficio clínico más duradero que la monoterapia con dabrafenib.
- Como ambos fármacos se dirigen a la vía MAPK, el bloqueo combinado puede evitar o retrasar la resistencia adquirida debido a la reactivación de la vía MAPK.