introduzione
Il 29 maggio 2013, la Food and Drug Administration (FDA) statunitense ha approvato trametinib (MEKINIST™ Tablets, GlaxoSmithKline, LLC), come trattamento a singolo agente per i pazienti con inoperabilità o metastatico melanoma con BRAF V600E o V600K mutazioni come rilevato da un test approvato dalla FDA, chiamato studio THxID™ – BRAF di bioMérieux SA Nel novembre 2015, la FDA ha approvato la combinazione di dabrafenib e trametinib per il trattamento del melanoma metastatico. Trametinib è approvato da MedSafe, da solo e in combinazione con dabrafenib, ma non è supportato da PHARMAC in Nuova Zelanda.
Le mutazioni BRAF si verificano nel 50% di melanomi. Obiettivi di trametinib mutante BRAF proteina inibendo il MAPK via di segnalazione, che media la crescita e la sopravvivenza cellulare.
Come funziona trametinib?
- Trametinib ha un meccanismo d'azione correlato, ma leggermente diverso, a dabrafenib.
- Agisce come una chinasi regolata dal segnale extracellulare attivata dal mitogeno (MEK) inibitore nella via di segnalazione della proteina chinasi attivata dal mitogeno (MAPK), che media la crescita e la sopravvivenza cellulare.
- RAS/RAF/MEK/ERK (tramite MAPK) è una cascata di trasduzione del segnale critica coinvolta nell'incontrollato proliferazione di molti tumori umani.
- In Cancro, mutante RAF (ad esempio, mutante B-RAF) e RAS proteina può portare all'iperattivazione della via MAPK, con conseguente aumento della proliferazione, diffusione e sopravvivenza cellulare.
- Le mutazioni che bloccano la proteina B-RAF in uno stato attivo possono causare un'eccessiva segnalazione nella via MAPK, portando a una crescita incontrollata di melanociti (pigmento cellule).
- Si ritiene che MEK sia un importante bersaglio farmacologico per il trattamento del cancro che può comportare un potenziamento della segnalazione RAS/RAF, a causa del suo ruolo centrale in questo percorso.
- Quando l'attività del B-RAF mutante viene bloccata MEK inibitori, le cellule tumorali smettono di crescere e muoiono.
Quali pazienti traggono maggior beneficio da trametinib?
- Trametinib è specificamente indicato per i pazienti con melanoma i cui tumori esprimono gene mutazioni denominate BRAF V600E e V600K, rilevate da un test approvato dalla FDA.
- La proteina BRAF prodotta come risultato di questo gene. mutazione avere il aminoacidi (componente base delle proteine) glutammato, al posto dell'aminoacido valina, in posizione 600.
- Trametinib non è indicato per l'uso nel melanoma senza la mutazione V600.
- Trametinib inoltre non è indicato per il trattamento di pazienti che hanno ricevuto in precedenza Inibitore BRAF terapia per il melanoma.
Link alle prove chiave degli studi clinici su trametinib.
Dosaggio e somministrazione
La dose raccomandata di trametinib è di 2 mg per via orale una volta al giorno, assunta almeno 1 ora prima o almeno 2 ore dopo un pasto. La dose dimenticata non deve essere assunta entro 12 ore dalla dose successiva.
In caso di pelle grave si raccomanda la modifica della dose o la sospensione parziale/completa del farmaco. tossicità, cardiomiopatia, oculare e polmonare anomalie.
Quali sono gli effetti collaterali di trametinib?
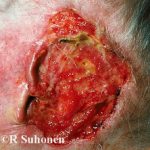
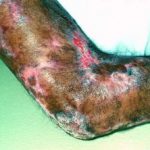
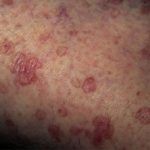
Negli studi clinici con trametinib, gli effetti indesiderati più frequenti che hanno interessato ≥10% di pazienti e di qualsiasi grado sono stati:
- eruzione (57%),
- diarrea (43%),
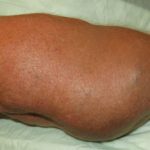
- linfedema (32%)
- acneiforme dermatite (19%)
- stomatite (15%)
- ipertensione (15%)
- dolore addominale (13%)
- emorragia (13%)
- pelle secca (11%)
- prurito/ prurito (10%)
- paronichia (10%).
Grave Reazioni avverse (che interessano ≥2%), cioè i gradi 3 e 4 erano:
- ipertensione (12%)
- eruzione (8%)
- prurito (2%)
- stomatite (2%).
Avvertenze e precauzioni
Negli studi clinici, sono state osservate anche le seguenti reazioni avverse con trametinib.
- Cardiomiopatia
11% dei pazienti ha sviluppato evidenza di cardiomiopatia (diminuzione dell'eiezione ventricolare sinistra frazione al di sotto dei limiti inferiori della norma). - pigmento retinico epiteliale distaccamenti
il incidenza il rapido distacco dell'epitelio pigmentato era 0,8%. I distacchi di retina erano frequenti bilaterale e multifocale, che si verifica nel maculare regione retinica. - vena retinica occlusione
L'incidenza dell'occlusione della vena retinica (RVO) è stata di 0,2%. RVO può portare a maculare edema, diminuzione della funzione visiva, neovascolarizzazione (nuovo vaso sanguigno Formazione e glaucoma. - Interstitial malattia polmonare
Alla dose raccomandata, malattia polmonare interstiziale o polmonite Si è verificato in 1.8% dei pazienti che hanno richiesto il ricovero.
La gravidanza
Trametinib può causare danno fetale se somministrato a donne in gravidanza (categoria di gravidanza D). Il paziente deve essere avvertito del potenziale pericolo per il feto se questo farmaco viene utilizzato durante la gravidanza o se il paziente rimane incinta durante l'assunzione di questo farmaco. I pazienti devono essere avvisati di usare contraccettivi altamente efficaci durante il trattamento con trametinib e per 4 mesi dopo l'interruzione del trattamento.
Pediatrico uso
Ad oggi, non sono stati condotti studi per valutare trametinib nei bambini.
Uso geriatrico
Gli studi clinici su trametinib non hanno incluso un numero sufficiente di soggetti di età pari o superiore a 65 anni per determinare se rispondono in modo diverso rispetto ai soggetti più giovani.
Epatica e renale disabilità
Non è stato condotto alcuno studio clinico formale per valutare l'effetto dell'insufficienza renale ed epatica sul farmacocinetica da trametinib. Non sono raccomandati aggiustamenti della dose nei pazienti con compromissione renale o epatica lieve in base alla popolazione. farmacocinetica studi.
Interazioni farmacologiche
Non sono stati condotti studi formali di interazione farmacologica per valutare il citocromo umano P450 (CYP). enzimaInterazioni farmacologiche mediate da trametinib.
Direzioni future per trametinib
- Rispetto alla maggior parte degli altri inibitori MEK in sviluppo, trametinib ha un profilo farmacocinetico (PK) unico che fornisce un'esposizione prolungata dopo una singola somministrazione giornaliera, con un basso rapporto di concentrazione picco-minimo e livelli sostenuti di molecolare obbiettivo inibizione.
- Dabrafenib e trametinib sono stati approvati per l'uso in monoterapia nel 2013. La combinazione di dabrafenib e trametinib, Mekinist™, è stata provvisoriamente approvata dalla FDA per non resecabile e melanoma metastatico con mutazioni BRAF V600E o V600K, nel 2014, e ha ottenuto l'approvazione regolare nel novembre 2015. La terapia di combinazione si rivolge a più componenti della segnalazione cellulare e fornisce tassi di risposta più elevati e benefici clinici più duraturi rispetto alla monoterapia con dabrafenib.
- Poiché entrambi i farmaci prendono di mira la via MAPK, il blocco combinato può prevenire o ritardare la resistenza acquisita a causa della riattivazione della via MAPK.