Invoering
In maart 2016 keurde de Amerikaanse FDA de biologische behandeling ixekizumab (TALTZ™ Eli Lilly, Indiana, VS) Voor de behandeling van psoriasis. In november 2017 werd het ook goedgekeurd voor actieve psoriasis. artritis.
In april 2016 verleende het Europees Geneesmiddelenbureau ook een vergunning voor het in de handel brengen van ixekizumab voor de behandeling van volwassenen met een matige tot ernstige ziekte. nummerplaat psoriasis die in aanmerking komen voor systemisch therapie.
Ixekizumab is een gehumaniseerd immunoglobuline G subklasse 4 (IgG4) monoklonaal antilichaam (mAb) met neutraliserende activiteit tegen IL-17A. Horloge interleukine-17 inch opruiend huidaandoeningen.
Het wordt geproduceerd door recombinant DNA technologie in een zoogdiercellijn en is samengesteld uit twee identieke lichte keten-polypeptiden van 219 aminozuren elk en twee identieke zware keten-polypeptiden van elk 445 aminozuren.
Waar wordt ixekizumab voor gebruikt?
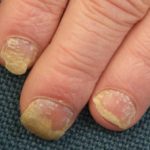
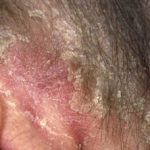
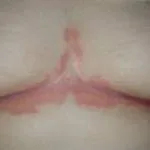
Ixekizumab wordt gebruikt voor de behandeling van matige tot ernstige plaque psoriasis bij volwassen patiënten die in aanmerking komen voor systemische therapie (geneesmiddel dat in de bloedbaan wordt opgenomen) of fototherapie (behandeling met ultraviolet licht). Het is ook aangetoond dat het psoriasis op de hoofdhuid verbetert en nagel psoriasis.
Hoe werkt ixekizumab?
- Psoriasis wordt gekenmerkt door: ontsteking Y keratinocyten hyperproliferatie dacht dat hij het was pathologisch gevolg van een T-cel–Immuun-gemedieerde reactie op een nog niet geïdentificeerd organisme auto-antigeen.
- Studies hebben aangetoond dat een subset van CD4+ T-cellen, type 17 helper T-cellen (Th17), kunnen een specifieke pathologische rol spelen bij psoriasis.
- Type 17 helper-T-cellen scheiden een reeks pro-inflammatoir cytokinen, waaronder interleukine-17A, een lid van de pro-inflammatoire interleukine-17 cytokine (Bezorgkoerier) eiwit) familie.
- Specifiek remming interleukine-17A vertegenwoordigt een nieuwe en gerichte benadering van de behandeling van psoriasis.
Dosering en administratie
- Ixekizumab wordt toegediend door: onderhuids injectie, met behulp van een auto-injector.
- De aanbevolen dosis is 160 mg (twee injecties van 80 mg) in week 0, gevolgd door 80 mg in week 2, 4, 6, 8, 10 en 12, daarna 80 mg om de 4 weken.
- Ixezinumab is verkrijgbaar als auto-injector voor eenmalig gebruik en als voorgevulde spuit.
- Patiënten kunnen zichzelf injecteren na training in de subcutane injectietechniek met behulp van de auto-injector of voorgevulde spuit.
- Elke injectie wordt gegeven op een andere anatomische locatie (zoals de bovenarmen, dijen of een kwadrant van de buik), maar niet in gebieden waar de huid gevoelig, gekneusd, erythemateus, moeilijk of aangetast door psoriasis.
- De gemiste dosis moet zo snel mogelijk worden toegediend. Daarna wordt de dosering hervat op het regelmatig geplande tijdstip.
- Haal vóór de injectie de TALTZ auto-injector of TALTZ voorgevulde spuit uit de koelkast en laat TALTZ op kamertemperatuur komen (30 minuten) zonder de naalddop te verwijderen.
- TALTZ is transparant en kleurloos tot lichtgeel. oplossing en mag niet worden gebruikt als de vloeistof zichtbare deeltjes bevat, verkleurd of troebel is.
Link naar belangrijk bewijs uit klinische onderzoeken met ixekizumab
Mogelijke geneesmiddelinteracties met ixekizumab
- niet formeel farmacokinetiek Er zijn onderzoeken naar geneesmiddelinteracties uitgevoerd met ixekizumab.
- CYP450-dosisaanpassing substraten zoals warfarine en ciclosporine bij het starten of stoppen van de behandeling met ixekizumab.
Wat zijn de bijwerkingen van ixekizumab?
Ixekizumab wordt zeer goed verdragen. Meest voorkomende (≥ 1%) Bijwerkingen geassocieerd met behandeling met ixekizumab zijn:
- Reacties op de injectieplaats
- bovenste luchtwegen infecties
- Misselijkheid
- schimmelinfecties
- Ringworm infecties.
Minder vaak voorkomende bijwerkingen (<1%) incluyen:
- Rhinitis
- spruw
- urticaria
- Influenza
- Conjunctivitis
- inflammatoire darmziekte
- angio-oedeem
Waarschuwingen en voorzorgsmaatregelen
- Patiënten moeten worden geïnstrueerd om medisch advies in te winnen als tekenen of symptomen van: chronisch of scherp infectie voorkomen.
- Ixekizumab verhoogt het risico op infectie en moet worden onderbroken totdat de infectie is verdwenen.
- Patiënten die ixekizumab krijgen, moeten tijdens en na de behandeling nauwlettend worden gecontroleerd op tekenen en symptomen van actieve tuberculose (TB).
- Ixekizumab mag niet worden toegediend aan patiënten met een actieve tuberculose-infectie.
- Behandeling van latent Tuberculose moet worden gestart vóór de behandeling met ixekizumab.
- Ixekizumab moet onmiddellijk worden stopgezet en een passende behandeling moet worden gestart in geval van ernstige overgevoeligheid reactie zoals kortademigheid, beklemmende keel, angio-oedeem of netelroos.
- Tijdens klinische onderzoeken, de ziekte van Crohn en zweren colitis, inclusief exacerbaties, kwamen vaker voor in de ixekizumab-groep (ziekte van Crohn 0,1%, colitis ulcerosa 0,2%) dan in de placebo groep (0%).
- Patiënten moeten worden gecontroleerd op het optreden of verergeren van inflammatoire darmaandoeningen tijdens de behandeling met ixekizumab.
- Vermijd het gebruik van levende vaccins bij patiënten die met ixekizumab worden behandeld.
Gebruik van ixekizumab tijdens de zwangerschap
- Er zijn geen gegevens beschikbaar over het gebruik van ixekizumab bij zwangere vrouwen.
- Van humaan IgG is bekend dat het de placentabarrière passeert en ixekizumab, een IgG4, kan van moeder op kind worden overgedragen. ontwikkelen foetus.
- In reproductieonderzoeken bij dieren, toediening van ixekizumab aan cynomolgus apen vanaf het begin van organogenese tot de bevalling leidde tot voortijdige foetale sterfte.
Gebruik van ixekizumab bij moeders die borstvoeding geven
- Het is niet bekend of ixekizumab of zijn metabolieten aanwezig zijn in de moedermelk.
- Vrouwen moeten worden geadviseerd om tijdens de behandeling te stoppen met borstvoeding.
pediatrisch gebruik van ixekizumab
De veiligheid en werkzaamheid van ixekizumab bij pediatrische patiënten (<18 años).
Geriatrisch gebruik van ixekizumab
Klinische onderzoeken met ixekizumab omvatten niet voldoende aantallen patiënten van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere patiënten.
nier of lever verslechtering en ixekizumab
Geen formeel onderzoek naar het effect van lever- of nierinsufficiëntie op de farmacokinetiek van ixekizumab.