Anno Domini
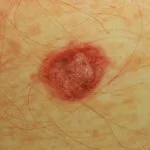
Cancro della pelle
Applicazione per facilitare l'autoesame della pelle e la diagnosi precoce. leggi di più.
Cos'è pembrolizumab?
Pembrolizumab (precedentemente noto come lambrolizumab; nome commerciale Keytruda®) è un farmaco commercializzato da Merck and Co (New Jersey, USA) che mira alla morte cellulare programmata 1 (PD-1) ricevitore. Il medicinale è destinato all'uso nel trattamento metastatico melanoma.
Il 4 settembre 2014, la Food and Drug Administration (FDA) statunitense ha approvato pembrolizumab come terapia innovativa per il trattamento del melanoma metastatico. È stato approvato per l'uso nel melanoma avanzato in Nuova Zelanda nel settembre 2015 ed è stato finanziato dalla New Zealand Pharmaceutical Management Agency (PHARMAC) per alcuni pazienti con non resecabile o melanoma metastatico a partire da settembre 2016. Pembrolizumab è utilizzato anche per il polmone metastatico non a piccole cellule carcinoma, alcuni casi Hodgkin linfoma, carcinoma uroteliale (marzo 2018) e cutaneo squamoso carcinoma cellulare (FDA, giugno 2020). Pembrolizumab è in fase di studio per altri tumori maligni. È stato segnalato che ha qualche effetto nei pazienti metastatici. La cellula di Merkel carcinoma.
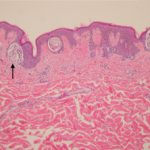
Melanoma metastatico
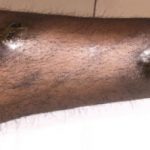
Metastasi cutanee da melanoma
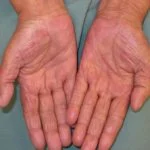
Metastasi del melanoma cutaneo
Metastasi del melanoma cutaneo
Quali pazienti con melanoma traggono beneficio dal trattamento con pembrolizumab?
Pembrolizumab è indicato per il trattamento di pazienti con melanoma non resecabile o metastatico.
Vedi le principali evidenze provenienti dagli studi clinici su pembrolizumab.
Terapia combinata con altri immunologico farmaci e diretti Cancro La terapia è in fase di studio e potrebbe migliorare i tassi di risposta.
Come funziona pembrolizumab?
Il recettore della morte programmata (PD-1) è una superficie molecola Espresso in antigene-stimolato Cellule T. tanto quanto monociti, Cellule B.e cellule dendritiche. Nelle cellule normali, il recettore PD-1 agisce come un recettore del checkpoint immunitario che consente l'autotolleranza delle cellule T, prevenendo autoimmune reazioni.
Quando non legato, PD-1 consente la normale risposta a Cellule T. procedere. Tuttavia, il legame di PD-1 ai suoi ligandi, il ligando 1 del recettore della morte programmata (PD-L1) e il ligando 2 della morte cellulare programmata (PD-L2), sopprime la risposta immunitaria inducendo una segnalazione a valle che inibisce la risposta immunitaria. proliferazione di cellule T, citochina rilascio e citotossicità.
L'espressione anomala di PD-L1 sulla superficie delle cellule di melanoma attiva PD-1 e lo sopprime citotossico Cellula T. attività. Questa tolleranza delle cellule T lo consente tumore cellule per evitare il riconoscimento e l’attacco da parte del sistema immunitario.
Pembrolizumab è un farmaco umanizzato altamente selettivo. monoclonale immunoglobuline G4 (IgG4) anticorpo che si lega al recettore PD-1 e blocca la sua interazione con PD-L1 e PD-L2, liberando la via mediata da PD-1 inibizione della risposta immunitaria contro le cellule tumorali.
Come viene somministrato pembrolizumab?
- La dose raccomandata di pembrolizumab è di 2 mg/kg somministrata tramite infusione endovenosa della durata di 30 minuti ogni 3 settimane fino alla progressione della malattia o al suo livello inaccettabile. tossicità.
- Pembrolizumab deve essere interrotto nei pazienti con: Reazioni avverse: Grado 2 polmonite, Grado 2 o 3 colite, Grado 2 nefrite, 3a elementare ipertiroidismo, aspartato aminotransferasi (AST) o alanina aminotransferasi (ALT)> 3 e fino a 5 volte il limite superiore della norma (ULN) o totale bilirubina > 1,5 e fino a 3 volte l'ULN. Oltre all'interruzione di questo farmaco, un ciclo di riduzione corticosteroidi può essere avviato.
- Pembrolizumab potrebbe essere ripreso nei pazienti le cui reazioni avverse regrediscono al Grado 0 o 1.
- Il farmaco deve essere sospeso definitivamente in caso di reazioni avverse di grado 3 o 4 e quando corticosteroide La dose in caso di reazioni avverse non può essere ridotta al di sotto di 10 mg/kg/die in 12 settimane.
Possibili interazioni farmacologiche con pembrolizumab
Non formale farmacocinetica Sono stati condotti studi di interazione farmacologica con pembrolizumab.
Quali effetti avversi può causare pembrolizumab?
Negli studi clinici, gli effetti indesiderati più comuni (≥20%) nei pazienti trattati con pembrolizumab 2 mg/kg ogni 3 settimane sono stati:
- Fatica
- Tosse
- Nausea
- Prurito (tritare)
- Eruzione (Non specificato)
- Diminuzione dell'appetito
- Stipsi
- Artralgia
- Diarrea.
Il più comune (≥ 2%) è grave Reazioni avverse ai farmaci osservati con pembrolizumab sono stati renale insufficienza respiratoria, dispnea (mancanza di respiro), polmonite e cellulite. Pembrolizumab può anche causare reazioni all'infusione, tra cui anafilassi.
Pembrolizumab può anche causare gravi effetti avversi immunomediati. In 411 partecipanti allo studio clinico con melanoma avanzato trattati con pembrolizumab, gli eventi avversi gravi immunomediati includevano polmonite, colite, ipofisite (infiammazione di ipofisi ghiandola), ipertiroidismo, ipotiroidismo e un altro endocrinopatie, nefrite e epatite. Successivamente sono state segnalate altre malattie autoimmuni associate a pembrolizumab.
Effetti avversi cutanei
Uno studio ha descritto effetti avversi cutanei verificatisi in 35 pazienti su 83 (42%) trattati con pembrolizumab. IL sviluppo dei problemi cutanei era associato a intervalli liberi da progressione più lunghi. Casi clinici hanno descritto altri problemi cutanei durante il periodo post-marketing del farmaco; Questi problemi della pelle hanno incluso:
- Morbilliform eruzione
- Prurito
- Lichene eruzione
- Psoriasi
- Eczema
- Vitiligine e poliosi (sbiancamento di capelli)
- Stomatite
- Bolloso pemfigoide
- Sarcoid-Mi piace granuloma
- Pannicolite
- Stevens - Johnson sindrome / tossico epidermico necrolisi
- Cheratoacantomi multipli.
L'oscuramento dei capelli è stato segnalato in alcuni pazienti che assumevano PD-1 inibitori per il cancro del polmone non a piccole cellule.
Vedi anche Effetti avversi cutanei di inibitori del checkpoint.
Psoriasi indotta da pembrolizumab
Psoriasi indotta da pembrolizumab
Psoriasi indotta da pembrolizumab
Psoriasi indotta da pembrolizumab
Eczema indotto da pembrolizumab
Eczema indotto da pembrolizumab
Eczema indotto da pembrolizumab
Pembrolizumab pemfigoide bolloso indotto
Pembrolizumab pemfigoide bolloso indotto
Pembrolizumab pemfigoide bolloso indotto
Pembrolizumab pemfigoide bolloso indotto
L’uso di pembrolizumab in popolazioni particolari
Donne incinte
- Pembrolizumab può causare danni al feto se somministrato a una donna in gravidanza. È elencato come farmaco di categoria D della FDA durante la gravidanza.
- Negli studi sugli animali, i rischi potenziali derivanti dalla somministrazione di pembrolizumab durante la gravidanza includevano un aumento dei tassi di aborto o di nati morti.
- È noto che le IgG umane, comprese le IgG4, attraversano la placenta; pertanto, pembrolizumab ha il potenziale per essere trasmesso dalla madre al figlio sviluppando feto.
- A seconda del suo meccanismo d’azione, l’esposizione del feto a pembrolizumab può aumentare il rischio di sviluppare disturbi immunomediati o di interrompere la normale risposta immunitaria.
Madri che allattano
Non è noto se pembrolizumab o il suo metaboliti Sono escreti nel latte materno. Poiché molti farmaci vengono escreti nel latte materno, le madri devono interrompere l’allattamento al seno prima di usare pembrolizumab.
Bambini
La sicurezza e l’efficacia di pembrolizumab nei bambini non sono state stabilite.
Anziani
In uno studio condotto su 411 pazienti trattati con pembrolizumab, 39% aveva 65 anni o più. Non ci sono differenze generali in termini di sicurezza o efficacia sono stati segnalati tra i pazienti più anziani e quelli più giovani.
Pazienti con insufficienza renale
Sulla base di un’analisi farmacocinetica di popolazione, non è necessario alcun aggiustamento della dose nei pazienti con compromissione renale.
Pazienti con epatica disabilità
Sulla base di un’analisi farmacocinetica di popolazione, non è necessario alcun aggiustamento della dose nei pazienti con lieve compromissione epatica. Pembrolizumab non è stato studiato in pazienti con compromissione epatica moderata o grave.