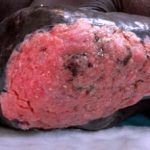
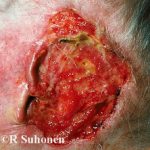
¿Qué es cemiplimab?
Cemiplimab (también llamado cemiplimab-rwlc; nombre comercial Libtayo®; Regeneron Pharmaceuticals Inc., Nueva York, EE. UU.) Es una monoclonal anticuerpo utilizado para pacientes con avanzado cutáneo escamoso célula carcinoma (SCC).
Cemiplimab fue aprobado por la Administración de Drogas y Alimentos de los EE. UU. (FDA) para pacientes con metastásico CCE cutáneo o CCE cutáneo localmente avanzado que no son candidatos para cirugía curativa o radiación curativa.
El cemiplimab fue evaluado por la FDA bajo revisión prioritaria, que está reservada para medicamentos que representan mejoras significativas en seguridad o eficacia en el tratamiento de enfermedades graves.
Cemiplimab es el primer y único tratamiento específicamente aprobado y disponible para el CCE cutáneo avanzado en los EE. UU. Regeneron y Sanofi-Aventis (Nueva Jersey, EE. UU.) Comercializarán cemiplimab de forma conjunta en EE. UU. Cemiplimab pertenece a una clase de agentes conocidos como agentes inmunes control inhibidores, que funcionan fortaleciendo la respuesta inmunitaria del cuerpo a los tumores.
En abril de 2018, la Agencia Europea de Medicamentos (EMA) aceptó para revisión la solicitud de autorización de comercialización de cemiplimab para el tratamiento de pacientes con CCE cutáneo metastásico o con CEC localmente avanzado que no son candidatos a cirugía.
Se prevé que el proceso de revisión de la EMA se completará para el primer semestre de 2019. Actualmente, no existen tratamientos aprobados por la EMA para el CCE cutáneo avanzado. Actualmente, también se está considerando la presentación de solicitudes reglamentarias en otros países.
Cemiplimab no está disponible actualmente en Nueva Zelanda.
Evidencia de ensayos clínicos para cemiplimab
Resultados fundamentales del programa clínico de CCE cutáneo avanzado
La aprobación de cemiplimab por la FDA se basó en un análisis combinado de datos de un abierto, multicéntrico, noaleatorizado Ensayo de fase II conocido como EMPOWER-CSCC-1 (estudio 1540) y dos cohortes de expansión de CCE cutáneo avanzado de un ensayo de fase I multicéntrico, abierto y no aleatorizado (estudio 1423). Juntos, estos ensayos representaron el mayor conjunto de datos prospectivos en CCE cutáneo avanzado.
Las principales medidas de resultado de eficacia para EMPOWER-CSCC-1 y las dos cohortes de expansión cutánea de SCC fueron la tasa de respuesta objetiva (ORR) confirmada según la evaluación de una revisión central independiente (ICR) y la duración de la respuesta evaluada por ICR.
Para pacientes con SCC cutáneo metastásico sin objetivo visible externamente lesiones, La ORR se determinó mediante los criterios de evaluación de respuesta en Sólido Tumores (RECIST 1.1). Para pacientes con visible externamente lesiones diana (CCE cutáneo localmente avanzado y metastásico), la ORR se determinó mediante un criterio de valoración compuesto que integraba las evaluaciones de ICR de radiológico datos (RECIST 1.1) y fotografía médica digital (criterios de la Organización Mundial de la Salud).
El análisis de eficacia se realizó cuando todos los pacientes tuvieron la oportunidad de al menos 6 meses de seguimiento.
Los pacientes recibieron cemiplimab 3 mg / kg por vía intravenosa cada 2 semanas durante un máximo de 48 semanas en el estudio 1423 o hasta 96 semanas en el estudio 1540. El tratamiento continuó hasta la progresión de la enfermedad, inaceptable toxicidado finalización del tratamiento planificado. Tumor Las evaluaciones de respuesta se realizaron cada 8 semanas.
Ambos estudios excluyeron a pacientes con:
- Autoinmune enfermedad que requirió sistémico terapia con agentes inmunosupresores dentro de los 5 años
- Una historia de órgano sólido trasplante
- Tratamiento previo con muerte celular antiprogramada proteína Bloqueo del ligando 1 (PD-1) / muerte programada 1 (PD-L1) anticuerpos u otro inmune control inhibidor terapias
- Infección con VIH
- Hepatitis B o hepatitis C
- Un estado funcional del Eastern Cooperative Oncology Group ≥ 2.
Los resultados de eficacia combinados (n = 108) de EMPOWER-CSCC-1 y las dos cohortes de expansión de CCE cutáneo avanzado del ensayo de fase 1 se resumen en la siguiente tabla:
| Criterios de valoración de eficacia * | CSCC metastásico (n = 75) | CSCC localmente avanzado (n = 33) | CSCC combinado (n = 108) |
| Respuesta objetiva confirmada (ORR) | |||
| ORR (intervalo de confianza del 95% [CI]) | 47% (35, 59) |
49% (31,67) |
47% (38, 57) |
| Tasa de respuesta completa† | 5% | 0% | 4% |
| Tasa de respuesta parcial | 41% | 49% | 44% |
| Duración de la respuesta (DOR) | |||
| Rango en meses | 3–15 + | 1–13 + | 1-15 + |
| Pacientes con DR> 6 meses, n (%) | 21 (60%) | 10 (63%) | 31 (61%) |
* Mediana duración del seguimiento: CCC metastásico: 8,1 meses; CSCC localmente avanzado: 10,2 meses; CSCC combinado: 8,9 meses
† Incluye pacientes con curación completa de afectación cutánea previa; Pacientes con CSCC localmente avanzados en EMPOWER-CSCC-1 requeridos biopsia para confirmar la respuesta completa.
Eventos adversos
Para el análisis de seguridad combinado (n = 163) de EMPOWER-CSCC-1 y las dos cohortes de expansión cutánea avanzada de SCC, los eventos adversos más comunes informados fueron:
- Fatiga (29%)
- Erupción (25%)
- Diarrea (22%).
En el 5% de los pacientes, se suspendió el cemiplimab de forma permanente debido a los siguientes eventos adversos:
- Neumonitis
- Autoinmune miocarditis
- Hepatitis
- Aséptico meningitis
- Dolor regional complejo síndrome
- Tos
- Debilidad muscular
Grave Reacciones adversas ocurrió en el 28% de los pacientes. Los AAG que ocurrieron en al menos el 2% de los pacientes fueron:
- Celulitis
- Septicemia
- Neumonía
- Neumonitis
- Infección del tracto urinario.
Las reacciones adversas que ocurrieron en menos del 10% de los pacientes con CCE cutáneo avanzado que recibieron cemiplimab en el Estudio 1423 y el Estudio 1540 incluyen:
- Erupción
- Prurito
- Diarrea
- Náusea
- Estreñimiento
- Fatiga
- Musculoesquelético dolor
- Disminucion del apetito.
Prueba de laboratorio anormalidades
Las anomalías de las pruebas de laboratorio de grado 3 y 4 que empeoraron por base en menos del 1% de los pacientes con CCE cutáneo avanzado que recibieron cemiplimab en el Estudio 1423 y el Estudio 1540 se enumeran a continuación.
Química
Las anomalías incluyeron:
- Aumento de aspartato transanimasa (3%)
- Aumento del índice internacional normalizado (2%)
- Hipoalbuminemia (1%).
Hematología
Las anomalías incluyeron:
- Linfopenia (7%)
- Anemia (2%).
Electrolitos
Las anomalías incluyeron:
- Hipofosfatemia (4%)
- Hiponatremia (3%)
- Hipercalcemia (1%).
Cemiplimab - potencial futuro
- El cemiplimab es una nueva opción de inmunoterapia importante para que los médicos ayuden a abordar una necesidad significativa no satisfecha en pacientes con SCC cutáneo avanzado que ya no son candidatos para cirugía curativa o radiación.
- El perfil de seguridad de cemiplimab observado en los ensayos fue consistente con el de otros agentes anti-PD-1 aprobados.
- Los resultados de los ensayos clínicos concluyeron que cemiplimab indujo una respuesta en aproximadamente la mitad de los pacientes con CCE cutáneo avanzado.
- El cemiplimab se está estudiando actualmente en ensayos de fase III para diversas indicaciones, incluido el pulmón de células no pequeñas metastásico. cáncer (NSCLC), NSCLC avanzado, cervical cáncer, y basal carcinoma celular.