¿Qué es Wiskott-Aldrich? síndrome?
El síndrome de Wiskott-Aldrich (WAS) es un trastorno de inmunodeficiencia hereditario poco común que provoca infecciones y también se asocia con microtrombocitopenia (baja plaqueta recuento y tamaño de plaquetas anormalmente reducido), eczema, un mayor riesgo de autoinmune enfermedades y algunos tipos de cáncer.
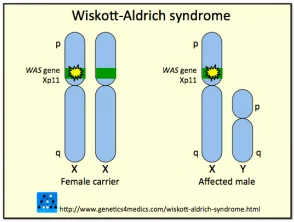
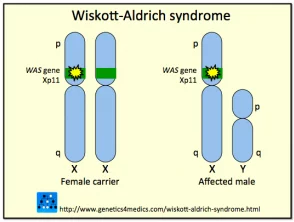
El síndrome se debe a mutaciones o eliminaciones en un gene encontrado en la X cromosoma que codifica el síndrome de Wiskott-Aldrich Proteína (AVISPA). La proteína WAS es fundamental en la señalización y la organización citoesquelética (estructural) de las células hematopoyéticas (sangre). Diferentes tipos de mutación dentro del gen WASP puede variar entre individuos dando como resultado la presencia del espectro clínico completo en algunos casos, o solo algunas de las características en otros.
Se han descrito aproximadamente 160 mutaciones o deleciones diferentes en el gen WASP. Debido a que el gen que codifica WASP está ligado al cromosoma X, la mayoría de los casos con síndrome de Wiskott-Aldrich son hombres; rara vez las niñas pueden verse afectadas. Se estima que el síndrome de Wiskott-Aldrich ocurre en aproximadamente 1 a 10 de cada millón de niños. Las mujeres con el gen anormal generalmente no se ven afectadas portadores que transmiten la mutación a la siguiente generación.
¿Cómo se clasifica el síndrome de Wiskott-Aldrich?
El síndrome de Wiskott-Aldrich se puede considerar como un espectro que se presenta con características que se encuentran entre las características graves del síndrome de Wiskott-Aldrich clásico y la forma menos grave llamada ligada al cromosoma X trombocitopenia (XLT). Los pacientes pueden cambiar de gravedad, dependiendo de la progresión de la enfermedad a lo largo del tiempo o de la aparición de complicaciones como la desarrollo de linfoma.
¿Cuáles son los síntomas del síndrome de Wiskott-Aldrich?
La trombocitopenia puede estar presente desde el nacimiento y causar sangrado prolongado de la umbilical cable. La trombocitopenia también causa petequias (señalar sangrado en la piel) y hematomas (equimosis) que puede ocurrir sin lesiones. La trombocitopenia también puede provocar hemorragias orales y nasales intestinales y intracraneal sangrado. El sangrado puede poner en peligro la vida.
El eccema afecta al 80% de los pacientes con síndrome de Wisckott-Aldrich. Normalmente, el eccema aparece durante la infancia o la primera infancia. Las características del eccema no se distinguen de atópico eczema. Los pacientes con síndrome de Wiskott-Aldrich a menudo tienen niveles elevados de IgE y desarrollar alergias.
La inmunodeficiencia puede afectar tanto a T como a B linfocito función. La inmunodeficiencia aumenta el riesgo y la frecuencia de una amplia gama de infecciones, incluida la secreción de oídos, bacteriano o neumonía viral, infecciones bacterianas de la piel y herpes simplex (virus del herpes labial). Pulmón oportunista infección con Pneumocystis jiroveci puede ocurrir.
El síndrome de Wiskott-Aldrich se puede asociar con una amplia gama de enfermedades autoinmunes, más comúnmente autoinmunes hemolítico anemia, cutáneo vasculitis, artritis y enfermedad renal. Los pacientes afectados pueden tener múltiples enfermedades autoinmunes al mismo tiempo.
Las neoplasias malignas más comunes asociadas con el síndrome de Wisckott-Aldrich son leucemia y linfoma de células B.
¿Cuáles son los hallazgos cutáneos en el síndrome de Wiskott-Aldrich?
Existe una variedad de hallazgos cutáneos en el síndrome de Wiskott-Aldrich:
- Causas del síndrome de Wiskott-Aldrich agudo y crónico eccema indistinguible del eccema atópico. Su severidad y persistencia son variables; en su forma más severa, es resistente a muchos de los tratamientos comunes para el eccema disponibles.
- Pueden ocurrir petequias y hematomas secundarios al rascado de eccematoso piel o espontáneamente sobre piel sin rasguños.
- Infecciones oportunistas de la piel como molusco contagioso, herpes simple y bacterias. septicemia tambien puede ser persistente o recurrente problemas para los pacientes con síndrome de Wiskott-Aldrich.
Genética del síndrome de Wiskott-Aldrich *
Síndrome de Wiskott Aldrich
* Imagen cortesía de Genetics 4 Medics
¿Qué pruebas pueden usarse en el diagnóstico del síndrome de Wiskott-Aldrich?
En la prueba de hemograma completo, el recuento de plaquetas casi siempre es bajo y el plaquetas son característicamente más pequeños de lo normal. En algunos casos, el recuento de plaquetas está dentro del rango normal, pero el tamaño de las plaquetas siempre se ve afectado. los neutrófilos y el recuento de linfocitos también puede ser bajo.
Si un bebé o un niño con eccema tiene signos de trombocitopenia y sospecha de inmunodeficiencia, debe realizarse un hemograma completo. Si hay trombocitopenia o se observan pequeñas plaquetas en el frotis de sangre, se recomienda la derivación a un pediatra.
Si hay una fuerte sospecha clínica de síndrome de Wiskott-Aldrich y hay hemograma completo anormalidades, el caso siempre debe discutirse con un pediátrico inmunólogo antes de realizar más investigaciones.
Inmunoglobulina (anticuerpo) los niveles en el torrente sanguíneo pueden ser bajos en el síndrome de Wiskott-Aldrich. El síndrome de Wiskott-Aldrich clásico se asocia con:
- niveles bajos de inmunoglobulina M (IgM) e inmunoglobulina G (IgG)
- Niveles de inmunoglobulina A (IgA) e inmunoglobulina E (IgE) de normales a altos.
Sin embargo, los bebés pequeños, en particular, pueden no mostrar las anomalías clásicas de las inmunoglobulinas porque el síndrome de Wiskott-Aldrich se asocia con una disminución gradual inmunológico función.
Las respuestas de inmunoglobulinas a la vacunación pueden estar ausentes, especialmente las respuestas a las vacunas neumocócicas.
La prueba diagnóstica de confirmación para el síndrome de Wiskott-Aldrich es genético análisis de sangre linfocitos para identificar si existe una mutación o deleción específica dentro del gen WASP.
¿Cuáles son las opciones de tratamiento para el síndrome de Wiskott-Aldrich?
Célula madre hematopoyética trasplante, que suele ser un trasplante de médula ósea, es curativo para los pacientes con síndrome de Wiskott-Aldrich. Para aquellos con un hermano donante genéticamente compatible (aproximadamente el 20% de los pacientes), hay una tasa de supervivencia del 80%, y la tasa de supervivencia es solo un poco menor para un trasplante de donante compatible no emparentado. La tasa de supervivencia es menor y las complicaciones son más frecuentes para el trasplante de donante emparentado incompatible. El resultado mejora si el trasplante de células madre hematopoyéticas se realiza en una etapa temprana de la infancia.
antes de trasplante o si el trasplante no es una opción, los niños afectados pueden necesitar un tratamiento específico para la inmunodeficiencia y los problemas de sangrado que incluyen:
- Trimetoprim-sulfametoxazol profilaxis diariamente para prevenir la infección por Pneumocystis jiroveci
- Profilaxis con aciclovir para prevenir las infecciones por herpes simple
- Infusiones de inmunoglobulina intravenosa periódicas donde haya anomalías en Célula B función
- Plaquetas irradiadas y transfusiones de glóbulos rojos para tratar episodios hemorrágicos graves.
Las vacunas vivas como BCG y MMR son contraindicado. Anti-esteroides no esteroideosinflamatorio Se deben evitar los medicamentos (ibuprofeno, diclofenaco, aspirina y otros).
La terapia genética para el síndrome de Wiskott-Aldrich sigue siendo experimental.
Outlook ¿Cuál es el pronóstico para los niños con síndrome de Wiskott-Aldrich?
La esperanza de vida media de los niños con síndrome de Wiskott-Aldrich es de unos 15 a 20 años sin trasplante de células madre hematopoyéticas. Se espera que los niños injertados sobrevivan mucho más tiempo.
¿Qué información genética necesitan las familias?
Una vez que la genética anomalía se identifica en el niño afectado, su madre puede ser examinada para ver si es portadora del gen. Si lo hace, entonces tiene un 50% de riesgo de tener otros hijos afectados. También existe un 50% de riesgo de que transmita el gen a sus hijas, que se convierten en portadoras y pueden tener sus hijos afectados. Prenatal El diagnóstico está disponible para las familias afectadas.