Efalizumab (Raptiva ™) ya no está disponible. Se retiró del mercado en 2009. Esta página de información es solo de interés histórico.
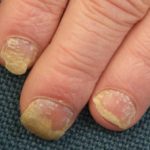
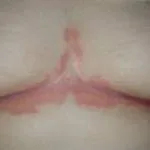
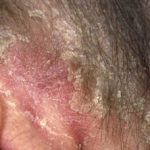
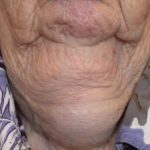
Efalizumab pertenece a la clase de modificadores de la respuesta biológica denominados Célula T bloqueadores. Es un tratamiento eficaz en pacientes con moderada a grave placa soriasis.
¿Como funciona?
Efalizumab es una forma de ratón modificada genéticamente proteína que está dirigido a bloquear célula T activación y proliferación uniéndose a los receptores CD11a en Células T. Esto evita que las células T liberen citocinas, que son los primario causa de la inflamación, enrojecimiento, picazón y parches cutáneos escamosos característicos de la psoriasis.
¿Cómo se administra?
Los ensayos iniciales de efalizumab incluyeron la administración intravenosa (IV) del fármaco. Sin embargo, un subcutáneo (CAROLINA DEL SUR) formulación se ha desarrollado y se está utilizando actualmente. La dosificación una vez a la semana durante un período de 12 semanas mejora la psoriasis hasta cierto punto en aproximadamente el 50% de los pacientes.
Las mejoras en la psoriasis realizadas después de 12 semanas de tratamiento se pueden mantener con dosis semanales adicionales o con dosis cada dos semanas.
Efectos secundarios
Efalizumab parece ser bien tolerado. Los efectos secundarios notificados con más frecuencia incluyeron dolor de cabeza, náuseas, escalofríos, dolor, fiebre y no específico infección como el resfriado común. Estos ocurrieron con mayor frecuencia después de la primera inyección y disminuyeron con las dosis posteriores.
Riesgos del tratamiento
Efalizumab es un agente inmunosupresor y por tanto aumenta susceptibilidad a infecciones.
ADVERTENCIA: 9 de abril de 2009. Genetech decidió retirar voluntariamente efalizumab (Raptiva) del mercado estadounidense debido a un riesgo potencialmente mayor de progresivo leucoencefalopatía multifocal (LMP).
19 de febrero de 2009. El Centro para la Evaluación e Investigación de Medicamentos de la Administración de Alimentos y Medicamentos de EE. UU. (FDA) emitió un Aviso de salud pública con información de seguridad actualizada sobre Raptiva (efalizumamb) debido a cuatro informes de pacientes que tomaron este medicamento que desarrollaron el raro cerebro potencialmente mortal infección, leucoencefalopatía multifocal progresiva (LMP) y otras infecciones.