Introducción
En marzo de 2016, la FDA de EE. UU. Aprobó el tratamiento biológico ixekizumab (TALTZ™ Eli Lilly, Indiana, EE. UU.) Para el tratamiento de la psoriasis. En noviembre de 2017, también lo aprobaron para psoriásicos activos. artritis.
En abril de 2016, la Agencia Europea de Medicamentos también concedió la autorización de comercialización de ixekizumab para el tratamiento de adultos con enfermedad de moderada a grave. placa psoriasis que son candidatos a sistémico terapia.
Ixekizumab es un humanizado inmunoglobulina G subclase 4 (IgG4) monoclonal anticuerpo (mAb) con actividad neutralizante contra IL-17A. Ver Interleucina-17 pulg inflamatorio trastornos de la piel.
Es producido por recombinante ADN tecnología en una línea celular de mamífero y está compuesta por dos polipéptidos de cadena ligera idénticos de 219 aminoácidos cada uno y dos polipéptidos de cadena pesada idénticos de 445 aminoácidos cada uno.
¿Para qué se utiliza ixekizumab?
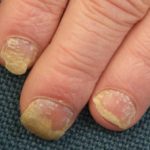
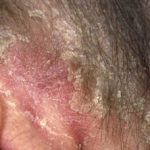
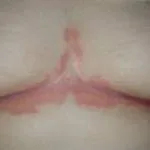
Ixekizumab se utiliza para tratar la psoriasis en placas de moderada a grave en pacientes adultos que son candidatos para terapia sistémica (medicamento que se absorbe en el torrente sanguíneo) o fototerapia (tratamiento con luz ultravioleta). También se ha demostrado que mejora la psoriasis del cuero cabelludo y uña soriasis.
¿Cómo actúa ixekizumab?
- La psoriasis se caracteriza por inflamación y queratinocito hiperproliferación pensó que era el patológico consecuencia de un Célula T–Respuesta inmunitaria mediada a un organismo aún no identificado autoantígeno.
- Los estudios han demostrado que un subgrupo de CD4 + Células T, las células T auxiliares tipo 17 (Th17), pueden desempeñar un papel patológico específico en la psoriasis.
- Las células T auxiliares de tipo 17 secretan una serie de proinflamatorio citocinas, incluida la interleucina-17A, un miembro de la interleucina-17 proinflamatoria citocina (Mensajero proteína) familia.
- Específico inhibición de interleucina-17A representa un enfoque novedoso y dirigido al tratamiento de la psoriasis.
Dosificación y administración
- Ixekizumab es administrado por subcutáneo inyección, utilizando un autoinyector.
- La dosis recomendada es de 160 mg (dos inyecciones de 80 mg) en la semana 0, seguida de 80 mg en las semanas 2, 4, 6, 8, 10 y 12, luego 80 mg cada 4 semanas.
- Ixezinumab está disponible como un autoinyector de dosis única y una jeringa precargada.
- Los pacientes pueden autoinyectarse después del entrenamiento en la técnica de inyección subcutánea usando el autoinyector o la jeringa precargada.
- Cada inyección se administra en una ubicación anatómica diferente (como la parte superior de los brazos, los muslos o cualquier cuadrante del abdomen) pero no en áreas donde la piel está sensible, magullada, eritematoso, endurecido o afectado por psoriasis.
- La dosis omitida debe administrarse lo antes posible. A partir de entonces, la dosificación se reanuda a la hora programada regularmente.
- Antes de la inyección, retire el autoinyector de TALTZ o la jeringa precargada de TALTZ del refrigerador y deje que TALTZ alcance la temperatura ambiente (30 minutos) sin quitar la tapa de la aguja.
- TALTZ es transparente e incoloro a un ligero amarillo. solución y no debe usarse si el líquido contiene partículas visibles, está descolorido o turbio.
Enlace a evidencia clave de ensayos clínicos sobre ixekizumab
Posibles interacciones farmacológicas con ixekizumab
- No formal farmacocinética Se han realizado estudios de interacciones medicamentosas con ixekizumab.
- Modificación de la dosis de CYP450 sustratos tales como warfarina y ciclosporina al iniciar o suspender el tratamiento con ixekizumab.
¿Cuáles son los efectos adversos del ixekizumab?
Ixekizumab se tolera muy bien. Más común (≥ 1%) Reacciones adversas asociados con el tratamiento con ixekizumab son:
- Reacciones en el lugar de la inyección
- Tracto respiratorio superior infecciones
- Náusea
- Infecciones por cándida
- Infecciones por tiña.
Las reacciones adversas menos comunes (<1%) incluyen:
- Rinitis
- Candidiasis oral
- Urticaria
- Influenza
- Conjuntivitis
- Enfermedad inflamatoria intestinal
- Angioedema
Advertencias y precauciones
- Se debe indicar a los pacientes que busquen consejo médico si los signos o síntomas de crónico o agudo infección ocurrir.
- Ixekizumab aumenta el riesgo de infección y debe suspenderse hasta que se resuelva la infección.
- Los pacientes que reciben ixekizumab deben ser monitoreados de cerca para detectar signos y síntomas de tuberculosis activa (TB) durante y después del tratamiento.
- Ixekizumab no debe administrarse a pacientes con infección activa por tuberculosis.
- Tratamiento de latente La tuberculosis debe iniciarse antes del tratamiento con ixekizumab.
- Ixekizumab debe suspenderse inmediatamente e iniciarse el tratamiento adecuado en caso de una grave hipersensibilidad reacción como dificultad para respirar, opresión de garganta, angioedema o urticaria.
- Durante los ensayos clínicos, enfermedad de Crohn y úlceras colitis, incluyendo exacerbaciones, ocurrió con mayor frecuencia en el grupo de ixekizumab (enfermedad de Crohn 0,1%, colitis ulcerosa 0,2%) que en el grupo placebo grupo (0%).
- Se debe vigilar a los pacientes para detectar la aparición o las exacerbaciones de la enfermedad inflamatoria intestinal durante el tratamiento con ixekizumab.
- Evite el uso de vacunas vivas en pacientes tratados con ixekizumab.
Uso de ixekizumab durante el embarazo
- No hay datos disponibles sobre el uso de ixekizumab en mujeres embarazadas.
- Se sabe que la IgG humana atraviesa la barrera placentaria y el ixekizumab, que es una IgG4, tiene el potencial de transmitirse de la madre al desarrollando feto.
- En estudios de reproducción animal, la administración de ixekizumab a monos cynomolgus desde el inicio de organogénesis hasta el parto resultó en muerte fetal prematura.
Uso de ixekizumab en madres lactantes
- No se sabe si ixekizumab o su metabolitos están presentes en la leche materna.
- Se debe advertir a las mujeres que dejen de amamantar durante el tratamiento.
Pediátrico uso de ixekizumab
No se ha establecido la seguridad y eficacia de ixekizumab en pacientes pediátricos (<18 años).
Uso geriátrico de ixekizumab
Los estudios clínicos de ixekizumab no incluyeron un número suficiente de pacientes de 65 años o más para determinar si responden de manera diferente a los pacientes más jóvenes.
Renal o hepático deterioro e ixekizumab
No se han realizado estudios formales sobre el efecto de la insuficiencia hepática o renal en el farmacocinética de ixekizumab.