¿Qué es risankizumab?
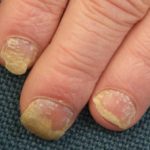
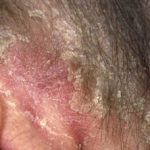
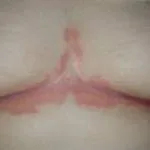
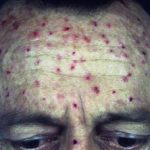
Risankizumab es un tratamiento biológico utilizado para la psoriasis, un trastorno de la piel en el que se forman células de la piel. escamoso rojo placas, que se encuentra comúnmente en los codos, las rodillas y la espalda baja.
Risankizumab es un interleucina Antagonista de IL-23 indicado para el tratamiento de moderados a graves placa psoriasis en adultos que son candidatos a sistémico terapia o fototerapia [1].
Risankizumab fue aprobado por la Administración de Drogas y Alimentos de los Estados Unidos (FDA) en abril de 2019, en Japón en marzo de 2019 y por la Unión Europea en marzo de 2019. Risankizumab tiene el nombre comercial Skyrizi ™ [AbbVie Inc., North Chicago, IL, USA] [1]. En enero de 2020, el risankizumab fue aprobado para su uso en Australia por la Terapéutica Goods Administration (TGA) y ha sido incluido en el Pharmaceutical Benefits Scheme (PBS) para pacientes con crónico psoriasis en placas que cumplen con las pautas de calificación.
Actualmente, el risankizumab no está disponible en Nueva Zelanda.
Psoriasis crónica en placas
Psoriasis crónica en placas
Psoriasis crónica en placas
Psoriasis crónica en placas
¿Cómo actúa risankizumab?
los proinflamatorio citocina Se cree que la IL-23 juega un papel fundamental en la Patogénesis de la psoriasis al inducir y mantener las células T auxiliares (Th) 17, las células Th22, innato linfoide células, y el efector citocinas IL-17, IL-22 y tumor necrosis factor-alfa.
Risankizumab pertenece a un pequeño grupo de humanizados inmunoglobulina G1 (IgG1) monoclonal anticuerpos que se dirigen a la IL-23, que se compone de dos subunidades p19 y p40 [2–4].
El fármaco se une a la subunidad p19 de IL-23 e interfiere con su capacidad para activar y mantener psoriásica. lesiones. El eje IL-23 / IL-17 actualmente se considera crucial en la patogenia de la psoriasis.
La activación y regulación al alza de IL-17 en piel prepsoriásica produce una inflamatorio respuesta en queratinocitos que impulsa el desarrollo de placas psoriásicas maduras al inducir epidérmico hiperplasia y epidérmico proliferación [3,4].
La subunidad p19 es exclusiva de IL-23, mientras que la subunidad p40 es común a IL-12 e IL-23.
Los datos sugieren que el bloqueo selectivo de IL-23 a través del inhibición de la subunidad p19 en lugar de p40 proporciona una inhibición más completa de la actividad de IL-23, lo que resulta en una mayor eficacia en el tratamiento de la psoriasis en placas [4–6].
¿Cómo se administra risankizumab?
La dosis recomendada es de 150 mg (dos inyecciones de 75 mg) administrada por subcutáneo inyección en la semana 0, semana 4 y cada 12 semanas a partir de entonces [7].
Las inyecciones deben administrarse en diferentes lugares anatómicos (como los muslos o el abdomen) y no en áreas donde la piel esté sensible, magullada, eritematoso, endurecido, o afectados por psoriasis.
Contraindicaciones a risankizumab
El principal contraindicación risankizumab es hipersensibilidad al Substancia activa oa cualquiera de los excipientes [7].
Advertencias y precauciones
Trazabilidad
Para mejorar la trazabilidad de los medicamentos biológicos, se debe registrar claramente el nombre y el número de lote del risankizumab administrado. [8].
Infecciones
Risankizumab puede aumentar el riesgo de infecciones al reducir la capacidad del sistema inmunológico del paciente para combatir las infecciones. En los estudios clínicos, se produjeron infecciones en el 22,1% de los pacientes tratados con risankizumab, en comparación con el 14,7% de los pacientes tratados con risankizumab. placebo grupo hasta 16 semanas de tratamiento [7].
El tratamiento con risankizumab no debe iniciarse en pacientes con algún activo clínicamente importante. infección hasta que la infección se resuelva o se trate adecuadamente.
En pacientes con una infección crónica o antecedentes de recurrente infección, considere los riesgos y beneficios antes de recetar risankizumab.
Evaluación previa al tratamiento de la tuberculosis
Se debe considerar la terapia antituberculosa antes de iniciar risankizumab en pacientes con antecedentes de latente o tuberculosis activa (TB) en la que no se puede confirmar un curso de tratamiento adecuado. Risankizumab no debe administrarse a pacientes con TB activa actual. Se debe monitorizar a los pacientes para detectar signos y síntomas de tuberculosis activa durante y después del tratamiento con risankizumab. [7]. (Consulte la página de DermNet NZ sobre detección de tuberculosis).
Vacunas
No hay datos disponibles sobre la respuesta a vacunas vivas o inactivadas. Se deben evitar las vacunas vivas en pacientes que reciben tratamiento con risankizumab. [7].
Modificación de dosis
Pacientes con renal o hepático discapacidad
No se han realizado estudios específicos para determinar el efecto de la insuficiencia renal o hepática en la farmacocinética de risankizumab [7].
Personas mayores
En los ensayos clínicos, no se han observado diferencias generales en la exposición, seguridad o eficacia de risankizumab entre sujetos mayores y más jóvenes. En estos ensayos, sin embargo, el número de sujetos de 65 años o más no fue suficiente para determinar si respondían de manera diferente a los sujetos más jóvenes. [7].
Niños
La seguridad y eficacia de risankizumab en pediátrico pacientes menores de 18 años aún no se ha establecido [7].
Uso de risankizumab en poblaciones específicas
Mujeres embarazadas
No hay datos disponibles sobre el uso de risankizumab en mujeres embarazadas para informar sobre los riesgos asociados al fármaco. Se sabe que la IgG atraviesa la barrera placentaria; por lo tanto, risankizumab puede transmitirse de la madre al desarrollando feto. Se informó un aumento de la pérdida fetal en studies en embarazadas monos cynomolgus tratado con 20 veces la dosis máxima recomendada para humanos [7].
Madres lactantes
No hay datos sobre la presencia de risankizumab en la leche materna, los efectos en el lactante o los efectos en la producción de leche. los de desarrollo y los beneficios para la salud de la lactancia materna deben tenerse en cuenta frente a cualquier posible efecto adverso en el lactante a causa de risankizumab [7].
Niños
No se ha establecido la seguridad y eficacia de risankizumab en niños menores de 18 años. [7].
Personas mayores
En los ensayos clínicos, no se han observado diferencias generales en la seguridad o eficacia entre los pacientes mayores de 65 años y los pacientes más jóvenes tratados con risankizumab. Sin embargo, el número de pacientes mayores de 65 años fue insuficiente para determinar si respondían de manera diferente a sujetos más jóvenes. [7].
Pacientes obesos y con bajo peso
El espacio libre y el volumen de distribución de risankizumab aumenta y plasma las concentraciones disminuyen a medida que aumenta el peso corporal; sin embargo, no se recomienda ningún ajuste de dosis en función del peso corporal [7].
Hombres fértiles
No se observaron efectos sobre los parámetros de fertilidad masculina en monos cynomolgus machos sexualmente maduros. subcutáneamente tratados con risankizumab 50 mg / kg (20 veces la dosis recomendada) una vez a la semana durante 26 semanas [7].
¿Cuáles son las posibles interacciones farmacológicas con risankizumab?
Citocromo P450 sustratos
No hubo cambios clínicamente significativos en la exposición a la cafeína (CYP1A2 sustrato), warfarina (sustrato de CYP2C9), omeprazol (sustrato de CYP2C19), metoprolol (sustrato de CYP2D6) o midazolam (sustrato de CYP3A) observado cuando se usa simultáneamente con risankizumab 150 mg administrados por vía subcutánea en las semanas 0, 4, 8 y 12 (con más frecuencia que la frecuencia de dosificación recomendada aprobada) en personas con psoriasis en placas [7].
Vacunas vivas
Debe evitarse el uso de vacunas vivas en pacientes que reciben tratamiento con risankizumab. [8]. Estas vacunas incluyen:
- Vacuna viva del virus de la influenza (las vacunas comunes son seguras)
- Vacuna tetravalente intranasal contra el sarampión, las paperas y la rubéola
- Vacuna oral viva contra el rotavirus
- Vacuna viva contra la viruela (vaccinia)
- Vacuna viva contra la fiebre tifoidea
- Vacuna viva contra el virus de la varicela o el herpes zóster
- Amarillo vivo fiebre vacuna.
¿Cuáles son los posibles efectos secundarios del risankizumab?
Los más comunes reacción adversa al medicamento que ocurrieron en más del 10% de los pacientes que recibieron risankizumab en ensayos clínicos fueron infecciones del tracto respiratorio superior, que ocurrieron en el 13% de los pacientes [7].
Las reacciones adversas a medicamentos que ocurrió en el 1 al 10% de los pacientes que recibieron risankizumab incluido [7]:
- Dolor de cabeza (3,5%)
- Fatiga (2,5%)
- Reacciones en el lugar de la inyección (1,5%)
- Infecciones por tiña (1,1%).
Infecciones graves que tenían menos del 1% incidencia de ocurrir como resultado de una reacción adversa a un medicamento incluido [7]:
- Celulitis
- Osteomielitis
- Septicemia
- Infección de herpes.