Introducción
En febrero de 2017, el tratamiento biológico brodalumab (Siliq ™; Valeant Pharmaceuticals, Nueva Jersey, EE. UU.) Recibió la aprobación de la Administración de Drogas y Alimentos de los EE. UU. (FDA) para tratar la psoriasis en pacientes adultos que no han respondido a otros tratamientos.
Valeant espera comenzar a comercializar y comercializar brodalumab en Estados Unidos en el segundo semestre de 2017.
Debido al riesgo observado de ideación y comportamiento suicidas, el etiquetado de brodalumab incluye una advertencia en un recuadro y el medicamento solo está disponible a través de un programa restringido bajo el Programa de Estrategias de Mitigación y Evaluación de Riesgos (REMS) de la FDA. A continuación se incluyen requisitos notables del programa.
- Los prescriptores deben estar certificados con el Programa REMS y asesorar a los pacientes sobre el riesgo de ideas y comportamientos suicidas.
- Los pacientes con síntomas nuevos o que empeoran de depresión o tendencias suicidas deben ser derivados a un profesional de salud mental, según corresponda.
- Los pacientes deben firmar un formulario de acuerdo entre el paciente y el prescriptor y ser consciente de la necesidad de buscar atención médica si experimentan pensamientos o comportamientos suicidas nuevos o que empeoran, sentimientos de depresión, ansiedad u otros cambios de humor.
- Las farmacias también deben estar certificadas con el Programa REMS y solo deben dispensar brodalumab a pacientes que estén autorizados a recibir el medicamento.
No se ha establecido una asociación causal entre el tratamiento con brodalumab y el aumento del riesgo de ideación y comportamiento suicidas.
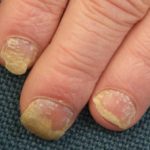
Psoriasis crónica en placas
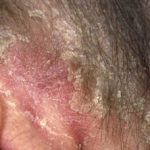
Psoriasis del cuero cabelludo
Psoriasis de manos
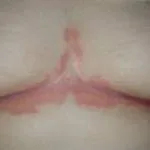
Psoriasis crónica en placas
¿Para qué se utiliza brodalumab?
Brodalumab se utiliza para el tratamiento de pacientes adultos con enfermedad de moderada a grave. placa psoriasis que son candidatos a sistémico terapia o fototerapia y no han respondido, o han dejado de responder a otras terapias sistémicas.
Se recomienda para candidatos para quienes la terapia sistémica o la fototerapia no han logrado proporcionar resultados o un tratamiento adecuado.
¿Cómo actúa brodalumab?
Brodalumab es un monoclonal inmunoglobulina G2 (IgG2) anticuerpo que inhibe inflamatorio reacciones y se une selectivamente a la receptor de interleucina 17 (IL-17), a citocina que inicia inflamación.
El receptor de IL-17 es un proteína expresado en la superficie celular y es un componente de los complejos de receptores utilizados por múltiples familias de IL-17 citocinas, tales como IL-17A, IL-17F, IL-17C, heterodímero IL-17A / F e IL-25. El bloqueo del receptor de IL-17 inhibe las respuestas inducidas por citocinas de IL-17, incluida la liberación de proinflamatorio citocinas y quimiocinas asociado con el Patogénesis de la psoriasis.
¿Cómo se administra brodalumab?
Se administra brodalumab subcutáneamente. Cada jeringa precargada (1,5 ml) contiene 210 mg de brodalumab y es para un solo uso.
- La dosis recomendada de brodalumab es de 210 mg administrados por subcutáneo inyección en las semanas 0, 1 y 2, seguida de 210 mg cada 2 semanas.
- Si no se ha logrado una respuesta adecuada después de 12 a 16 semanas de tratamiento, se debe interrumpir el tratamiento con brodalumab.
- Brodalumab no debe inyectarse en áreas donde la piel esté sensible, magullada, roja, dura, gruesa, escamoso, o afectados por psoriasis.
- Brodalumab es contraindicado en pacientes con enfermedad de Crohn porque el fármaco puede empeorar la enfermedad.
- Pacientes con antecedentes de latente La tuberculosis debe tratarse antes de la administración de brodalumab, que puede reactivar la tuberculosis latente. infección.
El uso de brodalumab en poblaciones específicas
Mujeres embarazadas
No hay datos disponibles sobre el uso de brodalumab en mujeres embarazadas para informar a los médicos del riesgo asociado al fármaco de defectos de nacimiento importantes y aborto espontáneo.
No adverso de desarrollo Se han observado efectos en monas preñadas después de la administración subcutánea de brodalumab hasta 26 veces la dosis máxima recomendada para humanos. (Consulte Seguridad de los medicamentos que se toman durante el embarazo para obtener más información).
Las mujeres en período de lactancia
No hay información sobre la presencia de brodalumab en la leche materna o sus efectos en el lactante. Se debe considerar el potencial riesgo-beneficio al prescribir brodalumab a una madre lactante. (Ver Lactancia y la piel).
Niños
No se ha evaluado la seguridad y eficacia de brodalumab en pediátrico pacientes.
Personas mayores
Los estudios clínicos con brodalumab no incluyeron un número suficiente de sujetos de 65 años o más para determinar si las personas mayores responderán de manera diferente a las personas más jóvenes.
Individuos con hepático o renal discapacidad
No se han realizado ensayos para evaluar el uso de brodalumab en pacientes con insuficiencia hepática o renal.
¿Cuáles son los riesgos de brodalumab?
Eventos adversos
Los más comunes Reacciones adversas (≥ 1% de los pacientes) notificados con brodalumab incluyen:
- Artralgia (dolor en las articulaciones)
- Dolor de cabeza
- Fatiga
- Diarrea
- Orofaríngeo dolor (dolor de garganta)
- Náusea
- Mialgia (dolor muscular)
- Reacciones en el lugar de la inyección
- Influenza
- Neutropenia (recuento bajo de glóbulos blancos)
- Hongos infecciones (como la tiña).
Se han notificado las siguientes reacciones adversas graves en ensayos clínicos en pacientes tratados con brodalumab:
- Ideación y comportamiento suicidas
- Infecciones graves como criptococos meningitis
- Reactivación latente de la tuberculosis
- Exacerbación de la enfermedad de Crohn.
Interacciones con la drogas
No hay datos disponibles sobre la capacidad de las vacunas vivas o inactivas para provocar una respuesta inmune en pacientes que reciben tratamiento con brodalumab. No se deben utilizar vacunas vivas durante el tratamiento con brodalumab.
El efecto de los fármacos metabolizados a través del citocromo P450 hepático enzimas (como warfarina y ciclosporina) pueden alterarse durante concurrente administración con brodalumab. Se debe considerar la modificación de las dosis de estos medicamentos.
Contraindicaciones
Brodalumab está contraindicado en personas que:
- Tiene antecedentes de problemas mentales, incluidos pensamientos suicidas, depresión, ansiedad o problemas del estado de ánimo.
- Tiene infecciones recurrentes
- Tiene tuberculosis o ha estado en contacto cercano con alguien con tuberculosis.
- Ha recibido recientemente o tiene previsto recibir una vacuna.
- Planea quedar embarazada
- Está amamantando actualmente o planea hacerlo.
¿Cuáles son las perspectivas para el tratamiento con brodalumab?
Brodalumab ha mostrado un perfil de seguridad aceptable y una buena eficacia en el tratamiento de la psoriasis en placas de moderada a grave. Proporciona una nueva terapia importante en el tratamiento de la psoriasis donde sigue existiendo una necesidad significativa no satisfecha de nuevos agentes con nuevos mecanismos de acción, un rápido inicio del efecto y una depuración total mejorada y sostenida de la piel, al tiempo que ayuda a una mayor adherencia del paciente y minimiza la seguridad específica del fármaco preocupaciones.
Sin embargo, la evidencia actual de brodalumab es insuficiente para confirmar el mantenimiento de estos resultados a largo plazo.