Wat is kunstmatige intelligentie?
Kunstmatige intelligentie (AI) gebruikt computersystemen om taken uit te voeren waarvoor normaal gesproken menselijke intelligentie nodig is, zoals spraakherkenning en visuele waarneming. AI vertrouwt op technologieën en algoritmen zoals robotica, machine learning en internet om na te bootsen hoe het menselijk brein werkt. Met onbeperkte rekenkracht en opslagcapaciteit heeft AI het potentieel om de mens te overtreffen.
In de geneeskunde hebben computervisie-algoritmen het potentieel om te herkennen afwijkingen en ziektes door kleur, vorm en patronen te evalueren [1].
Enkele voorbeelden van AI-toepassingen zijn:
- Technologie om autonome voertuigen mogelijk te maken
- Algoritmen voor spraakherkenning voor interactie met mensen, zoals SIRI van Apple, Alexa van Amazon en Google Assistant
- Taal Vertaling algoritmen
- Identificatie van hondenrassen (naar verluidt heeft een algoritme een nauwkeurigheid bereikt die beter is dan 96%)
- Voorspelling van gebruikersvoorkeuren, zoals een lijst met films of gerichte advertenties.
- Voorspelling van perioden met grote vraag naar taxi- of flexibele arbeid [2,3].
Hoe worden kunstmatige intelligentie en deep learning gebruikt in de geneeskunde?
Deep learning computeralgoritmen zijn gebaseerd op neuraal netwerken. Neurale netwerken zijn gebaseerd op een rekenmodel dat is geïnspireerd op de werking van het biologische brein. Een groot aantal verbonden knooppunten wordt kunstmatig genoemd. neuronen ze zijn vergelijkbaar met de biologische neuronen van de hersenen. Deze systemen leren de kenmerken van een object door handmatig getagde gegevens te evalueren, zoals 'hond' of 'geen hond'. De aangeleerde kenmerken kunnen worden gebruikt om de aard van een nieuwe afbeelding af te leiden.
De afbeeldingen worden veel gebruikt om verwondingen en ziekten te diagnosticeren en in studies van de menselijke anatomie en fysiologie. Geavanceerde medische beeldvormingstechnieken omvatten magnetische resonantie beeldvorming (Magnetische resonantie), dubbele röntgenabsorptiometrie, echografieY computertomografie (Connecticut) [4–10].
Bij medische beeldvorming worden convolutionele neurale netwerken gebruikt om 'abnormaal' of 'normaal' te bepalen. Ze zijn getraind op grote, gelabelde databases met medische beelden en komen overeen met of overtreffen het menselijke zicht voor objectdetectie in afbeeldingen op gebieden zoals:
- Borst kanker
- Brein tumor
- Huidkanker
- Ziekte van Alzheimer [11,12].
Deze computeralgoritmen zullen schaalbaar zijn naar meerdere apparaten, platforms en besturingssystemen, waardoor hun kosten worden verlaagd en hun beschikbaarheid voor diagnostiek en onderzoek wordt vergroot. Universiteiten, overheden en onderzoeksfinanciers erkennen de mogelijkheden om de vroege diagnose van ziekten, zoals kanker, hartaandoeningen, diabetes en dementie, te verbeteren en investeren zwaar in de sector.
AI-technieken die in september 2018 door de Amerikaanse Food and Drug Administration (FDA) zijn goedgekeurd voor klinisch gebruik, omvatten producten voor:
- Identificeer tekenen van diabetische retinopathie op netvliesbeelden
- Tekenen van een beroerte herkennen op CT-scans
- Visualiseer de bloedstroom in het hart.
- Detecteer huidkanker op basis van klinische beelden die zijn vastgelegd met een mobiele app.
Hoe wordt kunstmatige intelligentie gebruikt bij de diagnose van huidkanker?
Volgens de US Skin Cancer Foundation krijgen in de VS jaarlijks meer mensen de diagnose huidkanker dan alle andere vormen van kanker samen [13]. Huidkanker wordt gewoonlijk geclassificeerd als melanoma of niet-melanome huidkanker (de keratinocyten kankers basaal cel carcinoomY geschubd celcarcinoom). Huidkanker kan moeilijk te onderscheiden zijn van gewone. goedaardig huid verwondingenen het optreden van melanoom is bijzonder variabel. Dit betekent dat:
- Huidkanker kan over het hoofd worden gezien omdat men denkt dat ze onschadelijk zijn
- Een groot aantal onschuldige laesies wordt onnodig chirurgisch verwijderd om een potentieel gevaarlijke kanker niet over het hoofd te zien.
dermatologen onderzoek huidlaesies door visuele inspectie en dermatoscopie. Zij gebruiken hun ervaring in patroonherkenning om te bepalen welke huidlaesies moeten worden verwijderd voor diagnose of behandeling. De afgelopen jaren is er veel belangstelling geweest voor het gebruik van AI-algoritmen om te helpen blessure diagnose. Er zijn een aantal gegevenssets over huidlaesies die openbaar beschikbaar zijn om te helpen bij AI-onderzoek.
Onderzoekers van Stanford University voerden een dermatoloog-classificatie op het niveau van huidkanker met een deep learning-algoritme op een dataset van 129.450 klinische beelden waaronder 2.032 huidziekten [14]. Ze testten hun algoritme ook tegen 21 board-gecertificeerde dermatologen en ontdekten dat de prestaties van het algoritme op het gebied van rangschikking vergelijkbaar waren met die van hun experts.
De International Skin Imaging Collaboration (ISIC) biedt een uitgebreide openbare dataset die in september 2018 23.906 dermatoscopisch afbeeldingen van meer dan 18 soorten huidlaesies. Sinds 2016 organiseert ISIC ook jaarlijks een challenge 'Analyse van huidlaesies voor melanoomdetectie'. Hun uitdagingswinnaar in 2017 behaalde een nauwkeurigheid van meer dan 98% bij het onderscheiden melanomen van goedaardige moedervlekken [15]. ISIC nam vervolgens meer categorieën huidlaesies op in de uitdaging van 2018, zoals basaalcelcarcinoom en actinisch keratose. We kunnen verwachten dat er elk jaar meer precisie en meer huidlaesiecategorieën aan de competitie worden toegevoegd.
Machine learning-algoritmen voor huidlaesies
Om een nieuw machine learning-algoritme voor huidkanker te creëren, krijgt elk type huidlaesie een klasse toegewezen. In zijn eenvoudigste vorm kunnen er maar twee klassen zijn; bijvoorbeeld 'goedaardig' en 'kwaadaardige', of'naevus'en' melanoom '. De meest geavanceerde algoritmen kunnen meerdere klassen evalueren.
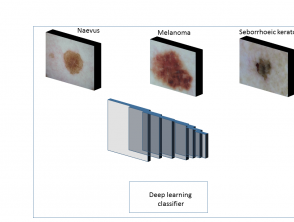
Voordat een algoritme met een nieuwe afbeelding wordt getest, worden in elke klas deep learning-algoritmen getraind op een groot aantal afbeeldingen. Het proces bestaat uit drie hoofdfasen (figuur 1).
Niveau 1
In fase 1 wordt het algoritme digitaal gevoed macroscopisch of dermoscopische beelden gelabeld met de 'onderste waarheid'. (De fundamentele waarheid in deze context is de diagnose van de laesie, die wordt toegewezen door een deskundige dermatoloog of het resultaat is van histopathologisch examen.)
Figuur 1. Overzicht van het trainen van verschillende soorten huidlaesies met behulp van deep learning
Samenvatting van het trainen van verschillende soorten huidlaesies met behulp van deep learning.
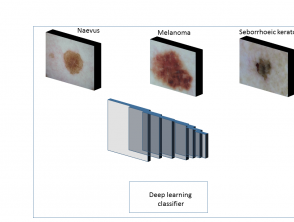
Stage 2
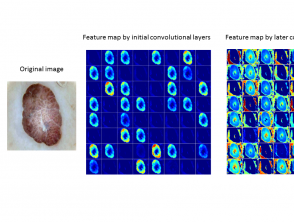
In fase 2 extraheren de convolutionele lagen (een reeks filters toegepast op de invoer, zoals een afbeelding) de functiekaart van de afbeeldingen. Een functiekaart vertegenwoordigt gegevens met meerdere abstractieniveaus.
- Initiële convolutionele lagen extraheren functies op laag niveau, zoals randen, hoeken en vormen.
- Daaropvolgende convolutionele lagen extraheren kenmerken van hoog niveau om het type huidlaesie te detecteren (figuur 2).
Figuur 2. Typische kenmerkkaarten die zijn geleerd met behulp van convolutionele neurale netwerken
Typische kenmerkkaarten die zijn geleerd met behulp van convolutionele neurale netwerken.
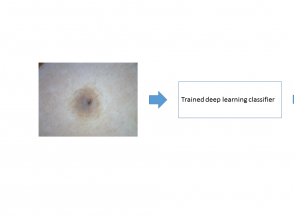
stadium 3
In fase 3 gebruikt de machine learning-classificator de functiekaarten voor patroonherkenning van verschillende klassen huidlaesies. Het deep learning-algoritme kan nu worden gebruikt om een nieuwe afbeelding te classificeren (figuur 3).
Figuur 3. Inferentie geproduceerd door deep learning-algoritmen op een nieuw beeld van een huidlaesie
Gevolgtrekking geproduceerd door deep learning-algoritmen op een nieuw beeld van een huidlaesie.
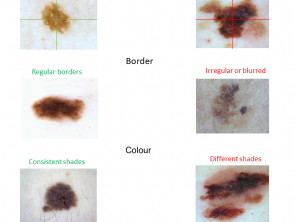
ABCD-criteria
De ABCD klinische criteria die door niet-experts worden gebruikt om te detecteren gepigmenteerd huidafwijkingen zijn EENsymmetrie, secondeonregelmatige volgorde, C.kleurvariatie, en met betrekking totdiameter groter dan 6 mm (figuur 4). Zie ABCDE's van melanoom, inclusief 'E' voor mijevolutie.
A: De eigenschap asymmetrie controleert of twee helften van de huidlaesie overeenkomen (of niet) qua kleur en vorm. Laesies worden verdeeld in twee helften langs de lange as en weer verdeeld langs de korte as. Melanoom heeft waarschijnlijk een asymmetrisch verschijning.
B: De grenseigenschap definieert of de randen van de huidlaesie glad en goed gedefinieerd zijn of niet. Huidkankers hebben vaak onregelmatige randen.
C: De kleureigenschap beoordeelt het aantal en de variabiliteit van kleuren in de huidlaesie. Melanoom en gepigmenteerd basaalcelcarcinoom bevatten vaak tinten van 3 tot 6 kleuren (zwart, bruin, donkerbruin, grijs, blauw, rood en wit), terwijl nevi en sproeten hebben meestal maar één of twee kleuren, die symmetrisch verdeeld zijn.
D: De eigenschap diameter meet de geschatte diameter van de huidlaesie. De diameter van kwaadaardige huidlaesies is meestal groter dan 6 mm (de grootte van een potloodgom).
Figuur 4. De ABCD-regel voor huidkanker
ABCD klinische regel van melanoom
Yang en collega's stelden voor om de ABCD-regel over te nemen voor algoritmen voor beeldverwerking en machine learning [16]. In hun werk vergeleken ze de prestaties van hun systeem met die van artsen (algemeen, junior en expert) en met deep learning-algoritmen voor de diagnose van huidlaesies die de dataset testen (tabel 1). Twee artsen uit elke categorie werden uitgenodigd om deze taak uit te voeren.
Ze trainden hun systeem op hun SD-198-dataset voor huidziekten van 6.584 klinische beelden uit 198 verschillende laesiecategorieën, en haalden low-level kenmerken uit drie visuele componenten: textuur, kleuren en randen. Yang's computer-aided device (CAD)-systeem presteerde beter dan het deep learning-algoritme VGG-Net en ResNet en was vergelijkbaar met de prestaties van beginnende clinici. Echter, deskundige dermatologen waren significant hoger naar het CAD-systeem.
| methoden | Nauwkeurigheid | Standaardfout | |
|---|---|---|---|
| Yang CAD-systeem | 56,47 | 53.15 | |
| medische deskundigen | Huisartsen (n = 2) | 49,00 | 47,50 |
| Artsen in opleiding (n = 2) | 52,00 | 53,40 | |
| Deskundige dermatologen (n = 2) | 83,29 | 85,00 | |
| diep leren | VGGNet | 50,27 | 48.25 |
| ResNet | 53,35 | 51.25 | |
Ander machine learning-onderzoek naar huidkanker
IBM werkt ook aan een hulpmiddel voor kunstmatige intelligentie, Watson genaamd, om afbeeldingen van huidlaesies te analyseren voor melanoomdetectie. Uw apparaat gebruikt zes belangrijke punten om de waarschijnlijkheid van melanoom te analyseren en te bepalen: kleur, onregelmatige randen, mate van asymmetrie, bloedcel en rood, gelijkenis met afbeeldingen van huidlaesies in hun database en melanoomscore; deze criteria zijn vergelijkbaar met de ABCD-criteria [17].
MetaOptima Technology Inc. heeft zijn DermEngine-platform gelanceerd om een teledermatologieservice aan te bieden. De visuele zoekfunctie vergelijkt een door een gebruiker ingezonden afbeelding met vergelijkbare afbeeldingen in een database van duizenden pathologie-Tagged afbeeldingen afkomstig van deskundige dermatologen van over de hele wereld. Deep learning-technieken worden gebruikt om gerelateerde afbeeldingen te vinden op basis van visuele kenmerken zoals kleur, vorm en patroon. [18].
Wat is de toekomst van kunstmatige intelligentie en de diagnose van huidkanker?
Er wordt onderzoek gedaan met AI Voortgang bij de diagnose van huidlaesies. AI zal medische experts in de nabije toekomst echter niet vervangen. Eerst is een mens nodig om de juiste laesie voor evaluatie te selecteren, vaak uit honderden onbeduidende laesies.
Medische diagnose is gebaseerd op het nemen van een zorgvuldige medische geschiedenis en het onderzoeken van de dossiers van de patiënt. Er wordt rekening gehouden met de etnische afkomst, huid, haar oogkleur, beroep, ziekte, medicijnen, bestaande schade door de zon, het aantal melanocytisch naevi en leefgewoonten (zoals blootstelling aan de zon, roken en alcoholgebruik). Het gedrag en de eerdere behandeling van de laesie zijn ook sleutels tot de diagnose.
AI kan een second opinion geven en kan worden gebruikt om een volledig goedaardige laesie uit te sluiten, zoals een melanocytaire naevus die symmetrisch qua kleur en structuur.
Deze algoritmen zullen onvermijdelijk evolueren met verbeterde nauwkeurigheid bij het detecteren van mogelijk kwaadaardige huidlaesies naarmate databases worden uitgebreid met meer afbeeldingen en meer patiënt- en laesiespecifieke labels.