Advertentie
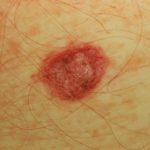
Huidkanker
Toepassing om zelfonderzoek van de huid en vroege detectie te vergemakkelijken. Lees verder.
Invoering
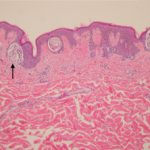
Melanoma is een potentieel ernstige vorm van huid kanker. Sommige patiënten hebben een gevorderd melanoom met een hoog risico op wederverschijning, voortgang en metastase, ondanks een operatie om de primair tumor.
intralesionaal /huidig De therapie kan worden gebruikt om therapie direct toe te dienen aan een lokaal recidief of metastase. Het doel van intralesionale therapie is om het doelwit te vernietigen blessure en stimuleren regressie van een ander, zonder te behandelen verwondingen het induceren van een immuunrespons op melanoom.
Er zijn verschillende agenten onderzocht, waaronder verschillende cytokinen (Bezorgkoerier) eiwitten), klein molecuul immunomodulatoren en virussen en plasmiden vectoren immunologisch actief tot expressie brengen moleculen.
Wie zijn de beste kandidaten voor lokale of intralesionale therapie voor melanoom?
Kandidaten voor intralesionale/topische melanoomtherapie zijn onder meer:
- Patiënten met inoperabel, meervoudig of geavanceerd op lokaal/regionaal niveau metastatisch Stadium IIIb / c of stadium IV M1a-melanoom, met of zonder verre ziekte
- Tumoren die toegankelijk zijn voor directe injectie
- Patiënten die andere agressieve therapieën niet kunnen verdragen
Effectieve middelen voor intralesionale / actuele immunotherapie van melanoom
Bacillus Calmette-Guerin (BCG) was de eerste beschreven intralaesionale behandeling.
- Het eerste gebruik van BCG zou resulteren in controleren in 90% van degenen die zijn geïnjecteerd intradermaal metastase en geïnduceerd systemisch immuunrespons op melanoom antigenen.
- In een ander onderzoek is een responspercentage van 17% gerapporteerd voor patiënten die intralesionale BCG-injectie ondergingen.
- Interesse in BCG nam af toen anafylactisch reacties en dood door verspreid BCG werd gemeld.
- volgend gerandomiseerd BCG-onderzoeken bevestigden geen significant klinisch voordeel en het gebruik ervan werd stopgezet.
Sinds de BCG-onderzoeken is er meer onderzoek gedaan naar intralesionale/topische therapie, samen met een verscheidenheid aan behandelmethoden, zoals:
- Kooldioxide Zijn
- cryotherapie
- Elektroporatie (ECT)
- cytotoxisch middelen (intralesionale cisplatine, topische 5-fluorouracil)
- Cytokines (intralaesionale interleukine [IL]-2 en interferon [IFN]-alfa en beta).
Van IL-2 is aangetoond dat het algemene responspercentages van 70% tot 80% en volledige responsen van 62.5% tot 69% produceert, maar de behandeling is tijdrovend, duur en heeft geen regressie van niet-geïnjecteerde laesies aangetoond.
De belangstelling is onlangs toegenomen voor drie onderzoeksagentia die tumoren op de injectieplaats lijken te vernietigen en systemische effecten teweegbrengen:
- OncoVEXGM-CSF
- Alovectine-7
- Roos van Bengalen (SV-10)
OncoVEXGM-CSF (T-VEC)
intralesionale injectie van granulocyt macrofaag koloniestimulerende factor (GM-CSF) bij melanoommetastasen resulteert in de infiltratie van macrofagen Y lymfocyten in de tumor. GM-CSF heeft een hoog responspercentage en biedt hoop op regionale immuunstimulatie en regressie van niet-geïnjecteerde laesies.
OncoVEXGM-CSF, nu T-VEC (Talimogene laherparepvec) genoemd, is een oncolytisch HSV-1-virus dat genetisch gemodificeerd is om de cytokine GM-CSF. Onderzoekers ontwierpen T-VEC door herpes te nemen simplex virus type 1a (het koortslipvirus) en introduceren genetisch mutaties om het vermogen om herpes te veroorzaken te verwijderen en het om te zetten in een kankerdodende therapie.
- Een klinische fase I-studie toonde een objectief responspercentage van 26% aan bij geïnjecteerde en niet-geïnjecteerde laesies (waaronder diepgeworteld stortingen).
- In een fase 2-onderzoek behaalde 20 procent van de patiënten een volledige respons en 28 procent behaalde een objectief responspercentage (volledige respons + gedeeltelijke respons). Tweeënnegentig procent van de reacties duurde ten minste zes maanden. de mediaan- totale overleving was 23,3 maanden in de T-VEC-groep en 19,0 maanden in de controlegroep.
Op basis van deze voorlopige resultaten is momenteel een internationaal prospectief gerandomiseerd fase 3 klinisch onderzoek bij patiënten met inoperabel stadium IIIB of IIIC of stadium IV (OPTiM) melanoom (2014) aan de gang.
- Fase 3 OPTim-studie heeft 436 patiënten met melanoom stadium IIIB/IV geïncludeerd, 2:1 gerandomiseerd naar T-VEC versus onderhuids Alleen GM-CSF.
- Tussentijdse resultaten van de OPTiM-studie toonden aan dat het virus de duurzame respons aanzienlijk verbeterde in vergelijking met alleen GM-CSF bij patiënten met gemetastaseerd melanoom (16.3% vs 2.1%; p <0,0001). Una respuesta duradera se definió como una respuesta completa o parcial que comenzó dentro de los 12 meses posteriores al inicio del tratamiento y duró 6 meses o más.
Alovectine-7®
Expressie van het belangrijkste histocompatibiliteitscomplex klasse I (MHC-I) is verminderd in melanoomcellen, waarvan wordt aangenomen dat ze herkenning kunnen ontwijken door T-cellen. Componenten van MHC-1 omvatten HLA-Microglobuline B7 en ß2.
Allovectin-7® is een HLA-B7/beta2-microglobuline-plasmide geformuleerd met kationisch lipiden. Verhoogt het vermogen van het immuunsysteem om kankercellen te herkennen en ze te doden. In 1999 verleende de Amerikaanse FDA de status van weesgeneesmiddel aan alovectine-7 voor de intralesionale behandeling van invasief en gemetastaseerd melanoom.
- In een fase 2-onderzoek met 133 melanoompatiënten was het totale responspercentage 12% zonder toxiciteit van graad 3 of hoger.
- Een fase 3-onderzoek met 2 mg intralesionale Allovectin-7® bij patiënten met melanoom in stadium III of IV toonde geen statistisch significante verbetering van het objectieve responspercentage na 24 weken of langer of de algehele overleving, in vergelijking met dacarbazine of temozolomide.
PV-10 (10% met Rose Bengal in zoutoplossing)
Bengaalse dinatrium (RB) is een fluoresceïnederivaat met een klein molecuul dat is gebruikt in radioactief gemerkte assays voor lever functie (hepatische RB radioactief gelabeld met 131I). Het wordt ook gebruikt als kleurstof in oogdruppels, omdat het beschadigde conjunctivale cellen kleurt.
Injecties van tien procent (w/v) RB in zoutoplossing (PV-10) kunnen ook worden gebruikt om gelegen tumoren zoals gemetastaseerd melanoom. RB hoopt zich op in de lysosomen van kankercellen, die binnen 30-60 minuten autofagie ondergaan. De tumorfragmenten worden vervolgens blootgesteld aan antigeen-presenterende cellen, resulterend in een toename van T-cellen in perifere bloed, inclusief cytotoxische CD3+- en CD8+-cellen, a immunologisch antitumor reactie.
fase 1 studie
- Elf patiënten met stadium III gemetastaseerd melanoom werden geïnjecteerd met PV-10 in een dosis van 0,5 ml/cc laesievolume. De behandeling werd goed verdragen en een objectieve respons werd waargenomen bij 12/26 doel laesies.
- Nog eens 28 onbehandelde laesies werden opgemerkt vanwege een mogelijk omstandereffect. Deze hadden een objectief responspercentage van 27% dat toenam tot 44% bij patiënten die een positieve respons hadden op de doellaesies.
fase 2 studie
- In een internationale multicenter studie bij 80 patiënten met stadium III-IV meetbaar melanoom, werden tot 4 intralesionale injecties van PV-10 toegediend met maandelijkse tussenpozen gedurende een periode van 16 weken, met een mediane dosis PV-10 per behandeling van 1. 6 ml.
- Vierentwintig procent van de patiënten had complete responsen (CR) van de doellaesies en 25 procent had partiële responsen (PR).
- Van de 38 proefpersonen met verwondingen van omstanders was de CR voor hun onbehandelde verwondingen 24 procent. De regressie van verwondingen van omstanders was sterk gecorreleerd met een reactie op letsels aan doelwitten.
- In een aanvullende analyse van de eerste 40 patiënten bereikten degenen met CR een significant langere progressievrije overleving (11,1 maanden) dan degenen met een stabiele ziekte of progressief ziekte (respectievelijk 2,8 en 2,7 maanden).
fase 3 studie
- Een fase 3-studie van PV-10 is aan de gang (2014) en zal naar verwachting tot 300 proefpersonen met stadium IIIB-IIIC melanoom inschrijven.
- In deze proef wordt PV-10 vergeleken met een controlegroep van chemotherapie met dacarbazine (DTIC) of temozolomide, met progressievrije overleving als primair eindpunt.
difencipron
Diphencyprone (DPCP) is een contactsensibilisator met immunomodulerende effecten, vaak gebruikt voor alopecia areata en virale wratten.
Recente rapporten geven aan dat actuele difencyprone (DPCP) effectief kan zijn tijdens het transport en huid gemetastaseerd melanoom alleen en in combinatie met cimetidine of dacarbazine en radiotherapie. Diphencyprone wordt verondersteld te werken door te promoten lymfocyt-gemedieerde tumorvernietiging, hoewel het exacte werkingsmechanisme onbekend is.
- In een Australisch onderzoek werden 50 melanoompatiënten behandeld met alleen DPCP gedurende ten minste 1 maand. DPCP verdund in water room het werd wekelijks aangebracht op de melanoomlaesies, 10 tot 14 dagen na sensibilisatie.
- Volledige klaring van de huidziekte werd waargenomen bij 46% en een gedeeltelijke respons bij nog eens 38% van de patiënten. de voor de helft De duur van de behandeling met DPCP tot het verdwijnen van alle huidlaesies was 8 maanden. De mediane duur van volledige respons was 17 maanden.
Imiquimod, een actuele immuunresponsmodificator, kan in DPCP worden toegevoegd hardnekkig gevallen. imiquimod heeft antiviraal en TH1-antitumor, gemedieerd door Toll-achtige activering ontvanger 7 en TLR 8 en de uitscheiding van verschillende cytokinen waaronder interferon, IL-1, IL-6, IL-8, IL-10 en IL-12. Het is eerder off-label gebruikt om melanoom te behandelen. in de plaats en cutaan gemetastaseerd melanoom.