introduzione
L'approvazione di vismodegib si è basata sui risultati dello studio cardine ERIVANCE Basale cellula carcinoma (BCC) studio.
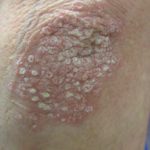
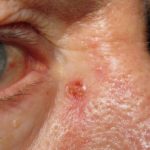
ERIVANCE BCC era un laboratorio internazionale, a braccio singolo, multicentrico, a due coorti, Aperto Nello studio di fase II sono stati arruolati 104 pazienti con BCC avanzato, inclusi BCC localmente avanzato (n = 71) e BCC metastatico (33).
Pazienti con BCC localmente avanzato lesioni che erano inappropriati per un intervento chirurgico (inoperabili o per i quali l’intervento chirurgico comporterebbe a deformità) e per il quale radioterapia non ha avuto successo o controindicato.
Il BCC metastatico è stato definito come BCC che si è diffuso ad altre parti del corpo, incluso il linfa nodi, polmoni, ossa e/o organi interni.
I 31 siti di studio erano situati negli Stati Uniti, in Australia e in Europa. I partecipanti allo studio hanno ricevuto vismodegib 150 mg per via orale, una volta al giorno fino alla progressione della malattia o al suo stato intollerabile tossicità.
il primario L'analisi è stata effettuata 9 mesi dopo il completamento della competenza.
Lo studio ha dimostrato che vismodegib ha ridotto sostanzialmente i tumori o guarito le lesioni visibili (tasso di risposta obiettiva o ORR) in 43% di pazienti con BCC localmente avanzato e in 30% di pazienti con BCC localmente avanzato metastatico BCC, valutato da una revisione indipendente, l'endpoint primario dello studio.
il mediano La sopravvivenza libera da progressione (PFS) secondo una revisione indipendente per i pazienti con BCC metastatico e localmente avanzato è stata di 9,5 mesi.
Inoltre, il tasso di beneficio clinico (definito come pazienti che hanno avuto una risposta clinica e quelli che hanno sperimentato stabilità della malattia per più di 24 settimane) è stato pari a 75% nei pazienti trattati con vismodegib.
In questi pazienti, vismodegib ha ridotto i tumori o curato le lesioni visibili, oppure ne ha impedito la crescita per più di 24 settimane.
L'ORR valutato dai ricercatori dello studio, un endpoint secondario, era 60% per il BCC localmente avanzato e 46% per il BCC metastatico.
I risultati principali sono elencati di seguito.
| Parametro | Carcinoma basocellulare metastatico (n = 33 pazienti valutabili) |
Carcinoma basocellulare localmente avanzato (n = 63 pazienti valutabili) |
|---|---|---|
| Tasso di risposta obiettiva, n (%) | 10 (30,3) [IC 95%: 15,6, 48,2] |
27 (42,9) [IC 95%: 30,5, 56,0] |
| Risposta completa, n (%) | 0 | 13 (20,6) |
| Risposta parziale, n (%) | 10 (30,3) | 14 (22,2) |
| Durata media della risposta (mesi) | 7,6 [IC 95%: 5,6. non stimato] |
7,6 [IC 95%: 5,7, 9,7] |
Nella coorte di BCC metastatico, tumore La risposta è stata valutata secondo i criteri di valutazione della risposta in Solido tumori (RECIST) versione 1.0.
RECIST è un insieme di regole pubblicate che definiscono quando Cancro I pazienti migliorano ("rispondono"), rimangono gli stessi ("stabilizzano") o peggiorano ("progressione della malattia") durante i trattamenti.
I criteri sono stati pubblicati nel febbraio 2000 da una collaborazione internazionale che comprende l'Organizzazione europea per la ricerca e la cura del cancro (EORTC), il National Cancer Institute degli Stati Uniti e il Clinical Trials Group del National Cancer Institute del Canada.
Nella coorte di BCC localmente avanzato, la valutazione della risposta tumorale includeva la misurazione del tumore valutabile esternamente (incluso cicatrice), valutazione per ulcerazione in fotografie, valutazione radiografica di lesioni mirate (se applicabile) e tumore biopsia.
La progressione della malattia è stata definita come una delle seguenti:
- ≥ 20% aumento lesione dimensione delle lesioni target (mediante radiografia o dimensione visibile esternamente)
- nuova ulcerazione delle lesioni target che persiste senza evidenza di guarigione per almeno 2 settimane
- nuove lesioni mediante valutazione radiografica o esame fisico
- progressione delle lesioni non target secondo RECIST.
La risposta obiettiva nel BCC localmente avanzato richiedeva almeno uno dei seguenti criteri e l'assenza di qualsiasi criterio per la progressione della malattia:
- ≥ 30% riduzione della dimensione della lesione [somma del diametro più lungo (SLD)] da base nelle lesioni target mediante valutazione radiografica
- Riduzione del SLD ≥ 30% rispetto al basale nella dimensione visibile esternamente delle lesioni target
- Risoluzione completa dell'ulcerazione in tutte le lesioni target.
La risposta completa nel BCC localmente avanzato è stata definita come una risposta obiettiva (come definita sopra) senza BCC residuo sulla biopsia del campionamento del tumore.
Aggiornamento a lungo termine (39 mesi) del test ERIVANCE BCC
- Centoquattro pazienti con BCC misurabilmente avanzato hanno ricevuto vismodegib orale 150 mg una volta al giorno fino alla progressione della malattia o alla tossicità intollerabile.
- Al momento del cut-off dei dati (39 mesi dopo il completamento dell'arruolamento), 8 pazienti stavano ricevendo il farmaco in studio.
- 69 pazienti (66%) sono rimasti nel follow-up di sopravvivenza.
- La durata mediana (intervallo) del trattamento con vismodegib è stata di 12,9 (0,7–47,8) mesi (13,3 [0,7–39,1] mesi nella coorte con BCC metastatico (mBCC) e 12,7 [1,1–47,8] mesi nella coorte con BCC localmente avanzato (la) ).
- Il tasso di risposta globale (ORR) valutato dallo sperimentatore, che rappresentava l'endpoint primario, è stato di 48,51 TP1T nel gruppo mBCC (tutte le risposte parziali) e 60,31 TP1T nel gruppo laBCC (20 pazienti). risposta parziale).
- La durata mediana della risposta è stata di 14,8 mesi (mBCC) e 26,2 mesi (laBCC).
- La sopravvivenza globale mediana è stata di 33,4 mesi nella coorte mBCC e non stimabile nella coorte laBCC.
- il incidenza relativo trattamento eventi avversi (TEAE) sono aumentati tra il momento dell'analisi primaria e la data limite finale dei dati.
- I TEAE più comuni di qualsiasi grado sono stati spasmi muscolari (71,2%), alopecia (66,3%), disgeusia (distorsione del senso del gusto; 55.8%), perdita di peso (51.9%), affaticamento (43.3%) e nausea (32.7%).
- Complessivamente, sono stati segnalati eventi avversi di grado ≥ 3 in 58 pazienti (55,8%), di cui il più comune è stato la perdita di peso (8,7%), seguita da spasmi muscolari (5,8%). Si sono verificati altri eventi avversi di grado ≥ 3, come affaticamento, diminuzione dell'appetito, diarrea e SCC <5% de los pacientes.
- Questo studio a lungo termine su vismodegib, che ha coinvolto 39 mesi di osservazione dopo aver completato l’arruolamento dei pazienti nello studio ERIVANCE BCC, rafforza l’utilità clinica di vismodegib nei pazienti con BCC avanzato per i quali le opzioni terapeutiche sono limitate e dimostra la durabilità della risposta a lungo termine. sicurezza vismodegib.
Lo studio SafeTy Events in VIsmodEgib (STEVIE) – studio post-approvazione
- Questo studio ha valutato la sicurezza e efficacia da vismodegib, il primo percorso a riccio del suo genere inibitore dimostrando un beneficio clinico nel carcinoma basocellulare avanzato (BCC), in una popolazione di pazienti rappresentativa della pratica clinica.
- In questo studio multicentrico in aperto, pazienti adulti con istologicamente LaBCC o mBCC confermati sono stati reclutati da centri di riferimento regionali o cliniche specializzate.
- I pazienti hanno ricevuto vismodegib orale 150 mg/die fino al progressivo malattia, tossicità inaccettabile o astinenza.
- L’obiettivo primario era la sicurezza (incidenza di eventi avversi fino alla progressione della malattia o al livello inaccettabile tossico effetti), con valutazioni il giorno 1 di ciascun ciclo di trattamento (28 giorni) da parte del ricercatore principale e dei co-investigatori in loco.
- Le variabili di efficacia sono state valutate come endpoint secondari.
Sicurezza
- La popolazione valutabile per la sicurezza comprendeva tutti i pazienti che avevano ricevuto almeno una dose del farmaco in studio.
- Pazienti adulti valutabili (nord = 1215, 1119 localmente avanzato; 96 mBCC) provenienti da 36 paesi sono stati trattati; 147 pazienti (12%) erano rimasti nello studio al momento della notifica. La durata mediana (intervallo) del trattamento è stata di 8,6 (0-44) mesi.
- Eventi avversi gravi correlati al trattamento (TEAE) si sono verificati in 289 pazienti (23,81 TP1T) e includevano un aumento epatica enzima, cutaneo squamoso carcinoma cellulare e deterioramento generale della salute fisica.
- La maggior parte dei pazienti (1.192 [98%]) ha avuto ≥1 TEAE nello studio; I TEAE più comuni (incidenza > 20%) sono stati:
- spasmi muscolari (807 [66%])
- alopecia (747 [62%])
- disgeusia (663 [55%])
- perdita di peso (493 [41%])
- diminuzione dell'appetito (303 [25%])
- astenia (291 [24%])
- L’esposizione ≥12 mesi non ha comportato un aumento dell’incidenza o della gravità di nuovi TEAE.
Efficacia
- Nell’analisi di efficacia sono stati inclusi i pazienti con BCC confermato istologicamente che hanno ricevuto almeno una dose del farmaco in studio.
- Il follow-up mediano è stato di 17,9 mesi e 1.161 pazienti nella popolazione valutabile per l’efficacia avevano una malattia misurabile confermata istologicamente.
- I tassi di risposta complessivi (valutati dallo sperimentatore) nei pazienti con malattia basale misurabile confermata istologicamente sono stati 68,5% (intervallo di confidenza (CI) 95%, da 65,7 a 71,3) nei pazienti con laBCC e 36,9% CI (valutato dallo sperimentatore) di 95%: da 26,6 a 48,1 ) in pazienti con mBCC.
- Tassi di risposta nei pazienti con Gorlin sindrome (cellula basale nevo sindrome) e la malattia misurabile confermata istologicamente erano 81,7% (CI 95% 75,8-86,7) e 80,0% (CI 95% 28,4-99,5) rispettivamente nei pazienti con mBCC e mBCC localmente avanzati.
L'analisi primaria di STEVIE ha mostrato che:
- vismodegib è tollerabile nei pazienti tipici nella pratica clinica
- L’esposizione a lungo termine non è stata associata a un peggioramento della gravità/frequenza dei TEAE
- I tassi di risposta valutati dallo sperimentatore hanno mostrato un alto tasso di tumori controllo.