Einführung
Im Juli 2017 hat die US-amerikanische Food and Drug Administration (FDA) Guselkumab (Tremfya™; Janssen Biotech, PA, USA) für die Behandlung von Erwachsenen mit mittelschweren bis schweren Symptomen zugelassen Nummernschild Psoriasis, die Kandidaten für sind systemisch Therapie oder Phototherapie. Guselkumab ist die erste und einzige zugelassene biologische Therapie, die nur selektiv blockiert Interleukin (IL)-23, bei Zytokin die bei Plaque-Psoriasis eine Schlüsselrolle spielt.
Guselkumab erhielt die FDA-Zulassung basierend auf den Ergebnissen einer klinischen Studie. Entwicklung Programm, das mehr als 2.000 Patienten in den Phase-III-Studien VOYAGE 1, VOYAGE 2 und NAVIGATE umfasste.
Im September 2017 verabschiedete der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur ein positives Gutachten, in dem die Genehmigung für das Inverkehrbringen in der Europäischen Union für die Anwendung von Guselkumab zur Behandlung von Erwachsenen mit mittelschwerer Plaque-Psoriasis empfohlen wird . für systemische Therapie.
Guselkumab ist derzeit in Neuseeland nicht erhältlich (Stand Januar 2018).
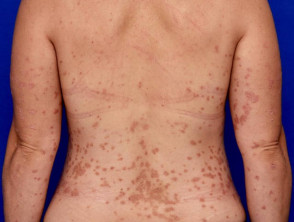
Mittelschwere bis schwere Psoriasis, geeignet für Guselkumab
Mittelschwere Psoriasis am Rücken
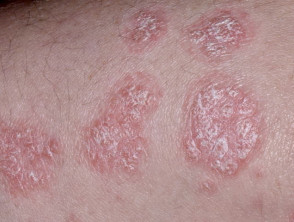
Chronische Plaque-Psoriasis
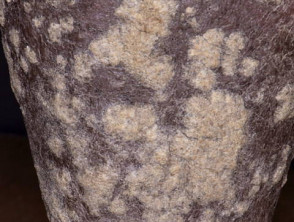
Psoriasis mit sehr dicken Schuppen
TRIP 1 und 2 (im Vergleich zu Guselkumab Placebo oder Adalimumab)
- Insgesamt wurden 1443 Patienten behandelt zufällig Guselkumab (100 mg in Woche 0 und 4 und danach alle 8 Wochen), Placebo oder Adalimumab (80 mg in Woche 0 und 40 mg in Woche 1, danach 40 mg jede zweite Woche).
- Die Patienten hatten einen Investigator's Global Assessment (IGA) Score von ≥ 3 (moderat) von 5 Punkten. Rahmen der allgemeinen Schwere der Erkrankung, ein Index der Schwere und des Bereichs der Psoriasis (PASI) Score ≥ 12 und minimale von 10% betroffene Körperoberfläche.
- Patienten mit Guttate, Erythrodermie oder pustelartig Psoriasis wurde ausgeschlossen.
- Die beiden coprimär Endpunkte waren (1) der Anteil der Personen, die einen IGA-Score von 0 (eliminiert) oder 1 (minimal) erreichten; und (2) der Anteil der Probanden, die mindestens eine Reduktion von 90% erreichten Base auf dem zusammengesetzten PASI-Score (PASI 90).
- Sowohl die VOYAGE 1- als auch die 2-Studie bewerteten das Ansprechen in Woche 16 im Vergleich zu Placebo für die beiden co-primären Endpunkte.
- Wirksamkeit Die Ergebnisse sind in Tabelle 1 zusammengefasst.
Tabelle 1. Wirksamkeitsergebnisse in Woche 16 bei Erwachsenen mit Plaque-Psoriasis im Vergleich zu Placebo in VOYAGE 1 und 2.
|
REISE 1 |
REISE 2 |
|||
|
Hauptvariable Anzahl Patienten (%) |
Guselkumab (n = 329) |
Placebo (n = 174) |
Guselkumab (n = 496) |
Placebo (n = 248) |
|
IGA-Antwort von 0/1 |
280 (85) |
12 (7) |
417 (84) |
21 (8) |
|
PASI 90-Antwort |
241 (73) |
5 (3) |
347 (70) |
6 (2) |
IGA, Prüfer-Global-Assessment-Score; PASI 90, 90%-Reduktion gegenüber dem Ausgangswert in Psoriasis Area und Severity Index Composite Score.
Vergleich von Guselkumab mit Adalimumab
Tabelle 2 stellt die Ergebnisse einer Analyse aller nordamerikanischen Prüfzentren (USA und Kanada) in den Studien TRIP 1 und 2 dar und zeigt die Überlegenheit von Guselkumab gegenüber Adalimumab.
Tabelle 2. Ergebnisse zur Wirksamkeit von Guselkumab im Vergleich zu Adalimumab bei Plaque-Psoriasis an den Standorten VOYAGE 1 und 2 in Nordamerika
|
REISE 1 |
REISE 2 |
|||
|
Schlusspunkt Anzahl Patienten (%) |
Guselkumab (n = 115) |
Adalimumab (n = 115) |
Guselkumab (n = 160) |
Adalimumab (n = 81) |
|
IgA-Antwort von 0 (klar) oder 1 (Minimum) |
||||
|
Woche 16 |
97 (84) |
70 (61) |
119 (74) |
50 (62) |
|
Woche 24 |
97 (84) |
62 (54) |
119 (74) |
46 (57) |
|
Woche 48 |
91 (79) |
62 (54) |
n / a |
n / a |
|
IGA-Antwort von 0 (gelöscht) |
||||
|
Woche 24 |
61 (53) |
27 (23) |
76 (48) |
23 (28) |
|
Woche 48 |
54 (47) |
28 (24) |
n / a |
n / a |
|
PASI 75-Antwort |
||||
|
Woche 16 |
105 (91) |
80 (70) |
132 (83) |
51 (63) |
|
PASI 90-Antwort |
||||
|
Woche 16 |
84 (73) |
47 (44) |
102 (64) |
34 (42) |
|
Woche 24 |
92 (80) |
51 (41) |
113 (71) |
41 (51) |
|
Woche 48 |
84 (73) |
53 (46) |
n / a |
n / a |
Reaktionsschnelle Wartung
Um die Aufrechterhaltung und Dauerhaftigkeit des Ansprechens in VOYAGE 2 zu beurteilen, wurden Patienten, die in Woche 0 auf Guselkumab randomisiert wurden und in Woche 28 auf PASI 90 ansprachen, alle 8 Wochen Guselkumab oder Placebo zugewiesen. In Woche 48 behielten 89% der Patienten, die die Guselkumab-Behandlung fortsetzten, den PASI 90 im Vergleich zu 37%, die auf Placebo umgestellt wurden.
Vom Patienten gemeldete Ergebnisse
Laut dem Psoriasis Signs and Symptoms Journal (PSSD) zeigten die mit Guselkumab behandelten Patienten in Woche 16 in den VOYAGE-Studien 1 und 2 größere Verbesserungen bei Juckreiz, Schmerzen, Stechen, Brennen und Hautspannung im Vergleich zu Placebo der mit Guselkumab behandelten Patienten im Vergleich zu Adalimumab erreichten eine PSSD Symptom Score von 0 (keine Symptome) in Woche 24 in beiden Studien.
Nebenwirkungen mit Guselkumab (TRIP 1 und 2)
Da klinische Studien unter sehr unterschiedlichen Bedingungen durchgeführt werden, unerwünschtes Ereignis Die in klinischen Studien beobachteten Raten spiegeln möglicherweise nicht die in der Praxis beobachteten Raten wider. Tabelle 3 fasst die häufig beobachteten Nebenwirkungen in den Studien VOYAGE 1 und 2 zusammen.
Tabelle 3. Nebenwirkungen, die bei Patienten ≥ 1% bis Woche 16 in den Trip-1- und Trip-2-Studien auftraten
|
Nebenwirkungen Anzahl der Ereignisse (% der Patienten) |
Guselkumab (n = 283) |
Adalimumab (n = 196)
|
Placebo (n = 422) Nr. (%) |
|
obere Atemwege Infektionen |
118 (14,3) |
21 (10,7) |
54 (12,8) |
|
Kopfschmerzen |
38 (4,6) |
2 (1) |
14 (3,3) |
|
Reaktionen an der Injektionsstelle |
37 (4,5) |
15 (7,7) |
12 (2,8) |
|
Arthralgie |
22 (2,7) |
4 (2) |
9 (2,1) |
|
Durchfall |
13 (1,6) |
3 (1,5) |
4 (0,9) |
|
Magengrippe |
11 (1,3) |
4 (2) |
4 (0,9) |
|
Wanne Infektion |
9 (1,1) |
0 |
0 |
|
Herpes Simplex Infektion |
9 (1,1) |
0 |
2 (0,5) |
erhöhte Leber Enzyme
Erhöhte Leberenzyme wurden häufiger in der Guselkumab-Gruppe (2,61 TP1T) als in der Placebo-Gruppe (1,91 TP1T) berichtet. Von den 21 Patienten, die in der Guselkumab-Gruppe über erhöhte Leberenzyme berichteten, waren alle Ereignisse außer einem leicht bis mittelschwer und keines der Ereignisse führte zum Absetzen des Arzneimittels.
Sicherheit bis Woche 48
Die Häufigkeit von UE war ähnlich dem während der ersten 16 Behandlungswochen beobachteten Sicherheitsprofil.
NAVIGATE-Studie (Guselkumab im Vergleich zu Ustekinumab)
- In dieser Phase III werden randomisierte, Doppelblind Studie erhielten 871 Patienten öffnen Ustekinumab (45 mg oder 90 mg) in den Wochen 0 und 4.
- In Woche 16 wurden 268 Patienten mit unzureichendem Ansprechen auf Ustekinumab (IGA ≥ 2) randomisiert (doppelblind) zu Guselkumab 100 mg oder zur Fortführung der Ustekinumab-Behandlung. 585 von 871 Patienten (67%) mit einem IGA-Ansprechen von 0 (klar) oder 1 (minimal) in Woche 16 setzten die Behandlung mit Ustekinumab unverblindet fort.
- Der primäre Endpunkt war die Anzahl der Besuche, bei denen randomisierte Patienten von Woche 28 bis Woche 40 einen IGA 0/1 und eine mindestens zweistufige Verbesserung erreichten.
- PASI-Verbesserung ≥ 90% oder 100% (PASI 90/100) und Dermatologie Lebensqualitätsindex (DLQI) Score von 0 oder 1 wurden ebenfalls bewertet.
- das halb Die Anzahl der Besuche, bei denen die Patienten in den Wochen 28 bis 40 ein IGA-Ansprechen von 0 oder 1 und eine mindestens zweistufige Verbesserung erreichten, war in der Guselkumab-Gruppe signifikant höher als in der randomisierten Ustekinumab-Gruppe (1,5 vs. a 0,7, S <0,001).
- Ein größerer Anteil der Patienten in der Guselkumab-Gruppe im Vergleich zur Ustekinumab-Gruppe erreichte ein IGA-Ansprechen von 0 oder 1 und eine mindestens zweistufige Verbesserung in Woche 28 und Woche 52.
- Ein größerer Anteil der mit Guselkumab behandelten Patienten im Vergleich zu Ustekinumab erreichte in Woche 52 PASI 90, PASI 100 und einen DLQI-Score von 0 oder 1.
- Nach Woche 16 hatten 64,41 TP1T der Patienten in der Guselkumab-Gruppe und 55,61 TP1T der Patienten in der Ustekinumab-Gruppe mindestens ein UE; Infektionen waren die häufigste Art von UE.
- Insgesamt hatten 6,71 PT1T (n = 9) der Patienten in der Guselkumab-Gruppe mindestens ein schwerwiegendes UE im Vergleich zu 4,51 PT1T (n = 6) in der Ustekinumab-Gruppe.
- Tabellen 4 und 5 sind eine Zusammenfassung der wichtigsten Ergebnisse und Nebenwirkungen aus der NAVIGATE-Studie.
Tabelle 4. Ergebnisse zur Wirksamkeit von Guselkumab im Vergleich zu Ustekinumab in NAVIGATE.
|
Wirksamkeitsparameter |
Guselkumab (n = 135) |
Ustekinumab (n = 133) |
p-Wert |
|
Mittlere Anzahl der Besuche, bei denen die Patienten von Woche 28 bis Woche 40 ein IGA-Ansprechen von 0 oder 1 und eine mindestens zweistufige Verbesserung (im Vergleich zu Woche 16) erreichten |
1,5 |
0,7 |
P.≤ 0,001 |
|
Mittlere Anzahl der Besuche, bei denen die Patienten von Woche 28 bis Woche 40 ein IGA-Ansprechen von 0 erreichten |
0,9 |
0.4 |
P.≤ 0,001 |
|
Mittlere Anzahl der Besuche, bei denen die Patienten von Woche 28 bis Woche 40 einen PASI 90 erreichten |
2.2 |
1.1 |
P. ≤ 0,001 |
|
Anzahl der Patienten mit einem IGA-Ansprechen von 0 oder 1 und einer Verbesserung ≥ 2 Grad (im Vergleich zu Woche 16) in Woche 28 |
42 |
19 |
P. ≤ 0,001 |
|
Anzahl der Patienten mit einem PASI-90-Ansprechen in Woche 28 |
Fünfundsechzig |
30 |
P. ≤ 0,001 |
|
Anzahl der Patienten mit DLQI-Score > 1 in Woche 16, |
103 |
105 |
P. = 0,002 |
|
Anzahl der Patienten mit einem DLQI-Score von 0 oder 1 in Woche 52 |
40 |
20 |
|
|
Anzahl der Patienten mit einem PSSD-Score > 0 in Woche 16 |
123 |
126 |
|
|
Anzahl der Patienten mit einem PSSD-Score von 0 in Woche 52 |
25 |
12 |
P. <0.05 |
DLQI, dermatologischer Lebensqualitätsindex; Ermittler-Global-Assessment-Score; PASI 90, 90%-Reduktion gegenüber dem Ausgangswert im Psoriasis-Gebiet und Schweregrad-Index-Composite-Score; PSSD, Psoriasis-Symptome und Zeichentagebuch.
Tabelle 5. Unerwünschte Ereignisse während der Wochen 1 bis 60 bei Patienten, die in NAVIGATE randomisiert entweder Guselkumab oder Ustekinumab erhielten
|
Unerwünschtes Ereignis Anzahl der Ereignisse (% der Patienten) |
Guselkumab (n = 135) |
Ustekinumab (n = 133) |
|
Infektionen |
57 (41,5%) |
47 (35,3%) |
|
Nasopharyngitis |
23 (17%) |
23 (17,3%) |
|
Infektionen der Atemwege |
15 (11,1%) |
11 (8,3%) |
|
Reaktion an der Injektionsstelle |
7 (1,1%) |
0 |
|
kardiovaskuläres Ereignis |
2 (1,5%) |
1 (0,8%) |
|
Malignität |
2 (1,5%) |
0 |
Guselkumab: Zukunftspotenzial
- Guselkumab hat ermutigende Daten zur Wirksamkeit und Sicherheit bei der Behandlung von mittelschweren bis schweren Erkrankungen generiert. chronisch Plaque-Psoriasis.
- Ergebnisse aus klinischen Phase-III-Studien legen nahe, dass Guselkumab dies ist höher zu Placebo in Woche 16 und ist besser in der Lage, Psoriasis zu beseitigen oder fast zu beseitigen Platten im Vergleich zu Adalimumab. Die Wirkung hielt bis Woche 48 an.
- Phase-III-Studien mit Guselkumab berichten von einigen der bisher höchsten PASI-90-Raten (in Woche 16, 73,31 TP1T in TRIP 1 und 70,01 TP1T in TRIP 2). Das Potenzial von Guselkumab, bei Patienten ≥ 70% ein PASI-90-Ansprechen zu erzielen, deutet darauf hin, dass Guselkumab einen signifikant positiven Einfluss auf die Lebensqualität der Patienten haben kann.
- Die Ergebnisse der NAVIGATE-Studie belegten, dass Guselkumab bei Erwachsenen mit mittelschwerer bis schwerer Psoriasis eine erhebliche Wirksamkeit hatte und bei Patienten, die unzureichend auf Ustekinumab ansprachen, wirksamer war als Ustekinumab.
- Mögliche Gründe für die überlegene Wirksamkeit von Guselkumab im Vergleich zu Ustekinumab sind die zentrale Rolle von IL-23 in Pathogenese Psoriasis, stärkere IL-23-Blockade mit Guselkumab, höhere und häufigere Dosen von Guselkumab und/oder verstärkte Th17-Antworten bei Hemmung von IL-12.
- Das günstige AE-Profil von Guselkumab, das in Phase-III-Studien beobachtet wurde, legt nahe, dass IL-23 im Vergleich zu anderen Zytokinen ein Psoriasis-spezifischeres Zytokin sein könnte. Zytokine wie Tumor Nekrose Alpha-Faktor und IL-17.
- Insgesamt könnte die Ausrichtung auf IL-23, ein wichtiges Zytokin, das verschiedene andere Effektorzytokine antreibt, für die hohe Wirksamkeit und das anhaltende Ansprechen von Guselkumab bis Woche 48 verantwortlich sein.
- Weitere Langzeitstudien sind erforderlich, um die langfristige Wirksamkeit und Sicherheit von Guselkumab zu verstehen.