Was ist Cobimetinib?
Cobimetinib (Cotellic ™, Genentech Inc. California, USA) ist ein verschreibungspflichtiges Medikament, das in Kombination mit Vemurafenib zur Behandlung von Patienten mit Melanom.
Cobimetinib erhielt 2015 die Zulassung der US-amerikanischen Food and Drug Administration (FDA) in den USA. Im April 2017 hat Medsafe Cobimetinib zur Behandlung von Melanompatienten in Neuseeland zugelassen.
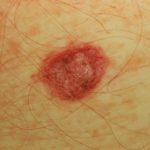
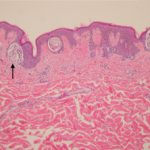
Metastasiertes Melanom
Metastasiertes Melanom
Metastasiertes Melanom
Metastasiertes Melanom
Wer sollte Cobimetinib einnehmen?
Cobimetinib ist in Kombination mit Vemurafenib angezeigt zur Behandlung von Patienten mit nicht resezierbar oder metastatisch Melanom, bei dem die Krebs die sich auf andere Körperteile ausgebreitet haben oder nicht operativ entfernt werden können. Ein Indikator für dieses Melanom ist eine Anomalie Gen Er rief die BRAF V600E oder V600K Mutation, die in bestätigt werden muss Tumor Proben vor Behandlungsbeginn.
Cobimetinib ist nicht angezeigt zur Behandlung von Patienten mit Normal- oder Wildtyp. BRAF Gen.
Wie wirkt Cobimetinib?
Cobimetinib ist ein kleines Molekül Inhibitor das blockiert die MEK Enzym, ein Bestandteil der Kinasekaskade in aktiviertem Mitogen Protein KinaseMAPK) Route. Bei Patienten mit der Böse Melanom, insbesondere das RAF Isoform BRAF. Mutationen von BRAF sie bewirken eine konstitutive Aktivierung dieser Signalwege, die zu Krebs führen kann.
Cobimetinib und Vemurafenib zielen auf zwei verschiedene Kinasen im MAPK-Signalweg ab. Klinische Studien haben gezeigt, dass die Kombination von Cobimetinib mit Vemurafenib das Überleben von Melanompatienten mit BRAF V600-Mutation.
Wie wird Cobimetinib verabreicht?
Empfohlene Dosis
Cobimetinib ist in 20 mg Tabletten unter dem Markennamen Cotellic erhältlich.
- Die empfohlene Dosis beträgt 60 mg einmal täglich für die ersten 21 Tage jedes 28-tägigen Zyklus, fortgesetzt bis zum Fortschreiten der Erkrankung oder bis zur Unverträglichkeit. Toxizität das passiert.
- Cobimetinib kann mit oder ohne Nahrung eingenommen werden.
- Wenn eine Dosis vergessen wurde oder bei Einnahme der Dosis Erbrechen auftritt, nehmen Sie die Einnahme mit der nächsten geplanten Dosis wieder auf.
Vemurafenib (ZELBORAF ™) sollte jeden Tag des 28-tägigen Zyklus alle 12 Stunden (ohne Ruhezeit) eingenommen werden. Wenn Sie eine Dosis von Vemurafenib vergessen haben, sollten Sie diese einnehmen, sobald Sie sich daran erinnern. Nehmen Sie die vergessene Dosis nicht nach, wenn die vergessene Dosis innerhalb von 4 Stunden nach der nächsten geplanten Dosis liegt.
Anwendung von Cobimetinib bei bestimmten Bevölkerungsgruppen
Schwangere Frau
Es liegen keine Daten zur Anwendung von Cobimetinib bei Schwangeren vor, um über ein arzneimittelbedingtes Risiko für schwere Geburtsfehler und Fehlgeburten zu berichten. Basierend auf den Ergebnissen von tierexperimentellen Reproduktionsstudien und seinem Wirkmechanismus kann Cobimetinib fetale Schäden verursachen. Schwangere sollten vor dem möglichen Risiko für den Fötus gewarnt werden.
Stillende Frauen
Es liegen keine Informationen über das Vorhandensein von Cobimetinib in der Muttermilch oder seine Auswirkungen auf ein gestilltes Kind vor. Bei der Verschreibung von Cobimetinib an die Mutter sollte das potenzielle Nutzen-Risiko-Verhältnis berücksichtigt werden. Stillenden Frauen sollte geraten werden, während der Cobimetinib-Behandlung und 2 Wochen nach der letzten Dosis nicht zu stillen.
Kinder
Die Sicherheit und Wirksamkeit von Cobimetinib bei Kindern wurde nicht untersucht.
Weibchen und Männchen im gebärfähigen Alter
Patienten im gebärfähigen Alter sollten angewiesen werden, während der Behandlung mit Cobimetinib und für 2 Wochen nach der letzten Dosis eine wirksame Empfängnisverhütung anzuwenden. Basierend auf Tierversuchen kann Cobimetinib die Fertilität bei Frauen und Männern mit Fortpflanzungspotenzial verringern.
Alte Leute
Klinische Studien mit Cobimetinib schlossen keine ausreichende Anzahl von Personen ab 65 Jahren ein, um festzustellen, ob sie anders ansprechen als jüngere Personen.
Einzelpersonen mit hepatisch oder Nieren- Behinderung
Bei Patienten mit leichter (Child-Pugh A-Score), mittelschwerer (Child-Pugh B) oder schwerer (Child-Pugh C) Leberfunktionsstörung ist keine Dosisanpassung von Cobimetinib erforderlich. Nicht engagiert Pharmakokinetik Es wurde eine Studie mit Patienten mit eingeschränkter Nierenfunktion durchgeführt. Basierend auf den Ergebnissen der populationspharmakokinetischen Analyse wird eine Dosisanpassung bei leichter bis mittelschwerer Nierenfunktionsstörung (Kreatinin-Clearance 30 bis 89 ml / Minute) nicht empfohlen. Eine empfohlene Dosis für Patienten mit schwerer Nierenfunktionsstörung wurde nicht festgelegt.
Welche Nebenwirkungen kann Cobimetinib haben?
Häufige Nebenwirkungen sind:
- Durchfall
- Eruption
- Lichtempfindlichkeit
- Übelkeit
- Stomatitis
- Fieber
- Alopezie
- Thrombozytopenie.
Zu den seltenen, aber potenziell schwerwiegenden Nebenwirkungen gehören:
- Schwerer Durchfall, der zu Dehydration und Nierenversagen führt.
- Rhabdomyolyse
- Herztoxizität
- Netzhautablösung
- Embryonale und fetale Toxizität
- Gelenkschmerzen (Arthralgie).
Hepatotoxizität
Höhen in Serum Aminotransferase und alkalisch Phosphatase Die Konzentrationen sind während der Vemurafenib-Therapie üblich und treten noch häufiger in Kombination mit Cobimetinib auf.
Fälle von klinisch offensichtlicher Leberschädigung mit Gelbsucht Sie wurden in klinischen Studien zur Therapie mit Cobimetinib und Vemurafenib berichtet, aber die klinischen Merkmale, der Verlauf und die Ergebnisse dieser Ereignisse wurden nicht im Detail beschrieben.
Der MAPK-Weg Inhibitoren als Klasse werden sie oft in Verbindung gebracht vorübergehend Erhöhungen der Serumenzyme und seltener mit Fällen von klinisch offensichtlicher Leberschädigung, aber die klinischen Merkmale wurden nicht beschrieben und die Assoziation mit Cobimetinib wurde nicht klar definiert.
Die Rate klinisch signifikanter Leberschädigungen und Leberversagen im Zusammenhang mit Proteinkinasehemmern ist bei Patienten mit Zirrhose oder Leberversagen aufgrund einer Lebertumorbelastung. Auf dem Produktetikett von Cobimetinib wird empfohlen, während der Behandlung routinemäßige Leberfunktionstests zu überwachen.
Erhöhungen der Serum-Aminotransferasen über das Fünffache der oberen Normgrenze (sofern bestätigt) sollten zu einer vorübergehenden Aussetzung führen, die dauerhaft werden sollte, wenn sich diese Laborwerte nicht signifikant verbessern oder innerhalb weniger Wochen abklingen.
Es scheint keine Kreuzreaktivität mit anderen zu geben Tyrosinkinase Empfänger Hemmstoffe. In manchen Situationen kann es angebracht sein, auf einen anderen Proteinkinase-Inhibitor umzusteigen.
Risiko neuer Krebserkrankungen
Cobimetinib in Kombination mit Vemurafenib kann neue Hautkrebserkrankungen verursachen. Diese können umfassen:
- Haut schuppig Zelle Karzinom
- Keratoakanthom
- Basal Zellkarzinom.
Herzprobleme
Kardiomyopathie, definiert als symptomatisch und asymptomatisch verminderter linksventrikulärer Auswurf Fraktion (LVEF), kann bei Cobimetinib auftreten.
Die Sicherheit von Cobimetinib bei Patienten mit Base LVEF, das unter der normalen unteren institutionellen Grenze oder unter dem 50% liegt.
Die LVEF sollte vor Beginn der Behandlung mit Cobimetinib, 1 Monat nach Beginn und danach alle 3 Monate bis zum Absetzen des Arzneimittels bestimmt werden. Linksventrikuläre Ereignisse Funktionsstörung sie muss durch Unterbrechung, Reduzierung oder Aussetzung der Behandlung behandelt werden.
Wechselwirkungen mit anderen Medikamenten
Cobimetinib wird in der Leber über das Cytochrom-P450-System, hauptsächlich CYP3A, metabolisiert und ist anfällig auf Arzneimittelwechselwirkungen mit potenten Inhibitoren oder Induktoren dieses mikrosomalen Enzyms.
Die gleichzeitige Anwendung von Cobimetinib mit Itraconazol (einem starken CYP3A4-Inhibitor) erhöhte Cobimetinib systemisch Belichtung in 6,7 mal.
Gleichzeitig Die Anwendung von Cobimetinib und starken oder mäßigen CYP3A-Inhibitoren sollte vermieden werden. Wenn eine gleichzeitige kurzzeitige Anwendung (14 Tage oder weniger) moderater CYP3A-Inhibitoren, einschließlich bestimmter Antibiotika (z. B. Erythromycin, Ciprofloxacin) unvermeidbar ist (14 Tage oder weniger), sollte die Cobimetinib-Dosis von 60 auf 20 mg reduziert werden.
Bei Patienten, die eine reduzierte Cobimetinib-Dosis (40 oder 20 mg täglich) einnehmen, sollte eine Alternative zu einem starken oder mäßigen CYP3A-Inhibitor verwendet werden. Nach Absetzen eines mäßigen CYP3A-Inhibitors sollte Cobimetinib mit der vorherigen Dosis wieder aufgenommen werden.
Die gleichzeitige Anwendung von Cobimetinib mit einem starken CYP3A-Induktor kann die systemische Exposition von Cobimetinib um mehr als 80% verringern und dessen Wirksamkeit. Die gleichzeitige Anwendung von Cobimetinib und starken oder mäßigen CYP3A-Induktoren, einschließlich, aber nicht beschränkt auf Carbamazepin, Efavirenz, Phenytoin, Rifampin und Johanniskraut, sollte vermieden werden.
Kontraindikationen
Die Anwendung von Cobimetinib sollte unter folgenden Umständen abgebrochen werden:
- Vorgeschichte von psychischen Problemen, einschließlich Selbstmordgedanken, Depressionen, Angstzuständen oder Stimmungsproblemen.
- Gleichzeitig Infektion das geht nicht weg oder kommt immer wieder
- Tuberkulose (TB) oder enger Kontakt mit jemandem mit TB
- Kürzlich erhaltene oder geplante Impfung
- Planen Sie schwanger zu werden
- Stillen oder planen zu stillen.